
【题目】蛋白质在胃蛋白酶和胰蛋白酶的作用下变成氨基酸的反应属于
A.消去反应B.聚合反应C.水解反应D.酯化反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物虽然种类繁多,但其命名是有规则的。下列有机物的命名正确的是( )
A. ![]() 1,4一二甲基丁烷 B.
1,4一二甲基丁烷 B. ![]() 3-甲基丁烯
3-甲基丁烯
C. HOOC-CH2-COOH丙二酸 D. CH2Cl-CH2Cl二氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:

①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(反应中的其他产物已略去)。请填空:

(1)若B是常见的两性氢氧化物
①若D是强酸,则能确定A中肯定含的离子的化学式是________。
②若D是强碱,则反应②的离子方程式是___________________________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体;B是汽车尾气之一,遇空气会变色;则反应①的化学方程式为_________________。
(3)若A、B、C的的焰色反应都呈黄色,D是一种无色无味的气态酸性氧化物,则反应③的离子方程式是_____________________________。
(4)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则用A制备漂白粉的化学方程式是_____________________。
②若A是某强酸的稀溶液,则A的化学式可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关生活中的醋酸,其中主要利用了醋酸酸性的是( )
①醋酸不小心滴到大理石桌面上,桌面失去光泽 ②熏醋可一定程度上防治流行性感冒 ③醋可以除去水壶中的水垢 ④用醋烹饪鱼,除去鱼的腥味
A.①③
B.②④
C.①④
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。
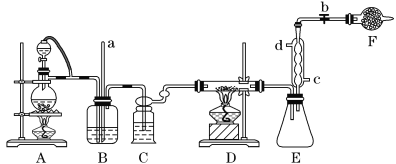
资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)检查该装置气密性的方法是_______________________________________________。
(2)实验中B装置的作用是____________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E处球形冷凝管的冷却水应从________(填“c”或“d”)口通入。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2![]() 2NH3,有关说法正确的是
2NH3,有关说法正确的是
A. 不同的催化剂对化学反应速率影响均相同
B. 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C. 新法合成能在常温下进行是因为不需要断裂化学键
D. 哈伯法合成氨是吸热反应,新法合成氨是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH![]() +3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
+3ClO-===N2↑+3Cl-+2H++3H2O。下列说法中不正确
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性:NH4+>Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水可以直接排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com