
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.100 g46%的甲酸水溶液中所含的氧原子数目为 5NA
B.常温下,1L pH=7 的 lmolL-1 CH3COONH4 溶液中 CH3COO-与![]() 数目均为NA
数目均为NA
C.11 g由![]() H和
H和![]() O组成的超重水中,含有的中子数目为 5NA
O组成的超重水中,含有的中子数目为 5NA
D.高温下 ,5.6gFe 与足量的水蒸气反应,转移电子数为0.3NA
【答案】A
【解析】
A.100g46%的甲酸溶液中甲酸的质量为46g,物质的量为1mol,故含2NA个氧原子;而水的物质的量为54g,物质的量为3mol,故含3NA个氧原子,故溶液中共含5NA个氧原子,故A正确;
B.CH3COONH4 溶液中CH3COO-与![]() 均会发生水解,pH=7说明CH3COO-与
均会发生水解,pH=7说明CH3COO-与![]() 水解程度相同,但依然水解,所以该溶液中两种离子的数目均小于NA,故B错误;
水解程度相同,但依然水解,所以该溶液中两种离子的数目均小于NA,故B错误;
C.![]() H和
H和![]() O组成的超重水的摩尔质量为(3+3+16)g/mol =22g/mol,一个超重水分子中所含中子数为2+2+8=12,所以11g该超重水的物质的量为
O组成的超重水的摩尔质量为(3+3+16)g/mol =22g/mol,一个超重水分子中所含中子数为2+2+8=12,所以11g该超重水的物质的量为![]() =0.5mol,所含中子数为6NA,故C错误;
=0.5mol,所含中子数为6NA,故C错误;
D.5.6g铁物质的量为![]() =0.1mol,铁与足量水蒸气反应生成四氧化三铁,铁的化合价升高到+
=0.1mol,铁与足量水蒸气反应生成四氧化三铁,铁的化合价升高到+![]() ,0.1molFe转移电子物质的量为0.1mol×
,0.1molFe转移电子物质的量为0.1mol×![]() ,电子数为
,电子数为![]() NA,故D错误;
NA,故D错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC(X)=-lgc(X),pKa=-lgKa,常温下,某浓度H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
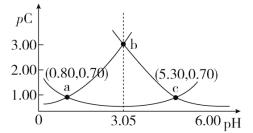
A.随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B.pH=4.50时,c(HA-)>c(A2-)=c(H2A)
C.b点时,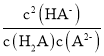 =104.50
=104.50
D.pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①向50mL小烧杯中加入20mL饱和FeCl3溶液并加热煮沸,制备氢氧化铁胶体
②家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂疏通,其主要成分为铝和氢氧化钠
③打印机(或复印机)使用的墨粉中的铁的氧化物是氧化铁
④“绿色化学”就是在生产结束后及时治理污染
⑤食品中适量添加二氧化硫可以达到去色、杀菌、抗氧化的作用
⑥对于可逆反应2HI(g)![]() H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
A.②⑤⑥B.①③⑥C.②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是化学中常用的物理量,请完成以下有关计算:
(1)0.2 g H2含有________个H原子。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)100 mL硫酸钠溶液中n(Na+)=0.20 mol,则其中c(SO42-)=________。
(4)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为________。
(5)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)基态 Ti 原子核外电子排布的最高能级符号是____。与钛同周期的元素中基态原子未成对电子数与钛相同的有__________种。
(2)钛比钢轻,比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_____。
(3)半夹心结构催化剂 M 其结构如图所示:
①组成该物的质元素中,电负性最大的是___________(填元素符号)
②M中不含_________(填标号)
a.π键 b.σ键 c.配位键 d.离子键 e.氢键
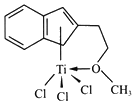
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式是______ 写出一种与阴离子![]() 互为等电子体的分子______ 。
互为等电子体的分子______ 。
(5)钛单质的晶胞如图所示,该晶胞为______堆积(填堆积方式),钛原子的配位数是_______,巳知晶胞参数:a=0.295nm,c=0.469nm。则该钛晶体的密度为___________g·cm-3(NA表示阿伏加德罗常数的数值,列出计算式即可)
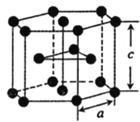
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):

(1)指出提取碘的过程中有关的实验操作名称:①________,③_____________。
(2)提取碘的过程中,可供选择的有机试剂是____________。
A.苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、酒精
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是_______。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出下图所示实验装置中的错误之处:
① ________________________ ②_______________________________ 、③_________
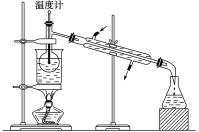
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)广泛应用于电子、陶瓷工业等领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A.AlN中氮的化合价为+3
B.AlN的摩尔质量为41 g
C.上述反应中,N2是氧化剂,Al2O3既不是氧化剂也不是还原剂。
D.上述反应中,每生成1 mol AlN需转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺”中,理想状态是反应中原子全部转化为欲制得产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯![]() 的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要其他的反应物是
A. CH2=CH2和CO B. CO和CH3OH C. CH3OH和H2 D. CO2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com