
试回答下列问题:
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为 。
(2)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸中HCl的物质的量浓度为 mol/L。
②若实验室配制450mL1.19 mol/L的稀盐酸,需用该浓盐酸________ mL,如下图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是_______________(填仪器名称)。

在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度____1.19mol/L (填“大于”“等于”或“小于”,下同)。若盐酸溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_______1.19mol/L。
(1)80g/mol (2分) (2) ①11.9 (2分) ②50 (2分) A、C (2分)
烧杯、玻璃棒(2分) 小于(1分) 小于(1分)
【解析】
试题分析:(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则根据质量守恒定律可知,C的质量=24g+40g-32g=32g,所以C的摩尔质量=32g÷0.4mol=80g/mol。
(2)①根据c= 可知,该盐酸的浓度c=
可知,该盐酸的浓度c=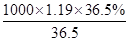 mol/L=11.9mol/L。
mol/L=11.9mol/L。
②由于实验室中没有450ml容量瓶,所以要配制450mL1.19 mol/L的稀盐酸,需用500ml容量瓶,则该浓盐酸的体积是V=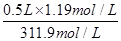 =0.05L=50ml。配制一定物质的量浓度溶液时需要的仪器主要是量筒、容量瓶、烧杯、玻璃棒以及胶头滴管,因此烧瓶和分液漏斗不需要,答案选AC。还缺少的仪器是烧杯和玻璃棒。若定容时仰视刻度线,则容量瓶中溶液的体积偏多,因此所得溶液浓度小于1.19mol/L;若盐酸溶液在转移至容量瓶时,洒落了少许,则溶质减少,因此所得溶液浓度小于1.19mol/L。
=0.05L=50ml。配制一定物质的量浓度溶液时需要的仪器主要是量筒、容量瓶、烧杯、玻璃棒以及胶头滴管,因此烧瓶和分液漏斗不需要,答案选AC。还缺少的仪器是烧杯和玻璃棒。若定容时仰视刻度线,则容量瓶中溶液的体积偏多,因此所得溶液浓度小于1.19mol/L;若盐酸溶液在转移至容量瓶时,洒落了少许,则溶质减少,因此所得溶液浓度小于1.19mol/L。
考点:考查物质的量以及物质的量浓度的有关计算、溶液配制、仪器选择和误差分析等


科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com