

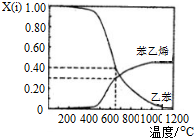
| 650℃ |
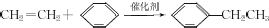 ,
,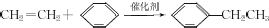 ;
;| 21 |
| 2 |
| 点燃 |
| 点燃 |
| 1 |
| 2 |
| 点燃 |
| 650℃ |
| 650℃ |
| 1-a |
| 1+a |
| a |
| 1 |
| a 2 |
| (1-a) |
| 9 |
| 28 |
| 9 |
| 28 |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c (H+)×c(OH-)=10-14的溶液 |
| B、n(H+)=n(OH-) 的溶液 |
| C、c (H+)=1.0×10-7 mol/L的溶液 |
| D、pH=3的酸与pH=11的碱等体积混合后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中形成的分散系属于悬浊液 |
| B、分子直径比Na+小 |
| C、在水中形成的分散系属于胶体 |
| D、“钴酞菁”分子既能透过滤纸,也能透过半透膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氢氧化钠固体放在滤纸上称量 |
| B、用100 mL量筒量取8.5 mL蒸馏水 |
| C、制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
| D、配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验燃尽的火柴头浸泡液中含有氯元素ClO3-+3NO2-+Ag+═AgCl↓+3NO3- |
| B、用淀粉碘化钾溶液和醋酸鉴别真假碘盐:IO3-+5I-+6H+=3I2+3H2O |
| C、用纸层析法分离Fe3+和Cu2+时,最后阶段充分氨熏:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+ |
| D、在硫酸亚铁溶液中加入等物质的量的硫酸铵,制备摩尔盐FeSO4+(NH4)2SO4+6H2O═(NH4)2SO4?FeSO4?6H2O↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
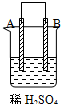 | 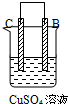 | 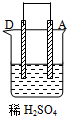 | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | X | Y | Z | W | 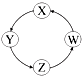 |
| ① | CuO | Cu(OH)2 | CuSO4 | Cu | |
| ② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 |
| B、CCl4萃取碘水中碘的实验,分液时,水层应从分液漏斗下口放出,CCl4层从应上口倒出 |
| C、用容量瓶配制溶液,定容时加水超过了刻度线,必须进行重新配制 |
| D、测定溶液pH时,应用干燥洁净的玻璃棒蘸取溶液点在pH试纸上跟标准比色卡对照 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com