

 .
. 分析 由H是六元环酯,又E?F→G,E?H,H?G,则EFG所含碳原子数相同,E是HOCH2CH2OH,F是OHCCHO,G是HOOCCOOH,又C和溴发生加成反应生成D,D和氢氧化钠的水溶液发生取代反应生成E,则D是CH2BrCH2Br,C是CH2=CH2,A和溴发生取代反应生成B,B和氢氧化钠的醇溶液发生消去反应生成乙烯,则B是CH3CH2Br,A是CH3CH3,据此分析解答.
解答 解:由H是六元环酯,又E?F→G,E?H,H?G,则EFG所含碳原子数相同,E是HOCH2CH2OH,F是OHCCHO,G是HOOCCOOH,又C和溴发生加成反应生成D,D和氢氧化钠的水溶液发生取代反应生成E,则D是CH2BrCH2Br,C是CH2=CH2,A和溴发生取代反应生成B,B和氢氧化钠的醇溶液发生消去反应生成乙烯,则B是CH3CH2Br,A是CH3CH3,
(1)G是HOOCCOOH,G中所含官能团的名称羧基;E→F的反应类型是氧化反应,故答案为:羧基;氧化反应;
(2)B→C的化学方程式:CH3CH2Br+NaOH$→_{△}^{乙醇}$NaBr+H2O+CH2=CH2,
故答案为:CH3CH2Br+NaOH$→_{△}^{乙醇}$NaBr+H2O+CH2=CH2;
(3)F中含有醛基,检验F中所含官能团可用新制氢氧化铜悬浊液试剂,F与该试剂反应的有关的化学方程式OHCCHO+4Cu(OH)2$\stackrel{△}{→}$HOOCCOOH+2Cu2O+4H2O,
故答案为:OHCCHO+4Cu(OH)2$\stackrel{△}{→}$HOOCCOOH+2Cu2O+4H2O;
(4)E是乙二醇,G是乙二酸,所以E+G→H的化学方程式为: ,
,
故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系是解本题关键,根据反应条件、官能团进行推断,题目难度不大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=30mol•L-1•min-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=48mol•L-1•min-1 | D. | v(D)=1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol CH4含有的电子数为NA | |
| B. | 标准状况下,22.4L己烷中共价键数为19NA | |
| C. | 6.4g CaC2固体中所含阴离子数为0.2NA | |
| D. | 1L 1mol/L的NaHCO3溶液中含有NA个HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1MgCl2溶液 | B. | 0.1mol•L-1NH4Cl溶液 | ||
| C. | 0.1mol•L-1KCl溶液 | D. | 0.1mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
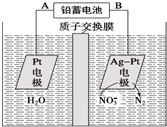
| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的总反应方程式为:2H2O+4NO3- $\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| C. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
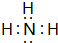 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com