
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
 (2分)
(2分) 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol,②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol,则根据盖斯定律可知①-②×3即得到6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol。
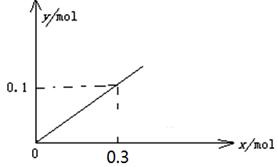
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol,②CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H=-357.5kJ/mol,则根据盖斯定律可知①-②×3即得到6Na2O(s)+ 2C(s,金刚石)=8Na(g)+ 2Na2CO3(l)△H= —8.4 kJ/mol。 2Al(OH)3+3H2↑,因此一段时间后,测得有0.3mol电子转移,则消耗水的物质的量是0.3mol,生成氢氧化铝是0.1mol,因此y随x变化的图象为(见答案)。
2Al(OH)3+3H2↑,因此一段时间后,测得有0.3mol电子转移,则消耗水的物质的量是0.3mol,生成氢氧化铝是0.1mol,因此y随x变化的图象为(见答案)。

科目:高中化学 来源:不详 题型:单选题
| A.物质发生化学变化都伴随着能量变化 |
| B.任何反应中的能量变化都表现为热量变化 |
| C.伴有能量变化的物质变化都是化学变化 |
| D.即使没有物质的变化,也可能有能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一 2C02(g) △H2="b" kJ·mol-
2C02(g) △H2="b" kJ·mol- 2FeO(s)△H3
2FeO(s)△H3
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B、C的物质的量随时间变化的关系如图l,达平衡后在
B、C的物质的量随时间变化的关系如图l,达平衡后在 时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是
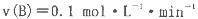
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 物质 物质T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |

 ΔH >0
ΔH >0| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
 CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。| A.体系压强不再变化 | B.H2与CO的物质的量之比为1 :1 |
| C.混合气体的密度保持不变 | D.气体平均相对分子质量为15,且保持不变 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
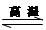 Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图⑵所示;回答下列问题:

 (正)
(正)  (逆)。
(逆)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com