
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 无法计算 |
分析 将Fe(NO3)2与HgNO3的混合物加热后,放出的气体通过排水法收集时得不到气体,此时的二氧化氮和氧气的混合反应为:4NO2+O2+2H2O=4HNO3,根据反应的方程式进行计算即可.
解答 解:Fe(NO3)2加热分解反应为4Fe(NO3)2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+8NO2↑+O2↑,Hg(NO3)2加热分解反应为Hg(NO3)2$\frac{\underline{\;加热\;}}{\;}$Hg+2NO2↑+O2↑,混合物加热后,放出的气体通过排水法收集时得不到气体,二氧化氮和氧气的混合反应为:4NO2+O2+2H2O=4HNO3,混合物中Fe(NO3)2 与Hg(NO3)2物质的量分别是x、y,则(2x+2y):(0.25x+y)=4:1,解得x:y=2:1,
故选B.
点评 本题考查学生二氧化氮和氧气在水溶液中的反应,配平方程式进行计算即可,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
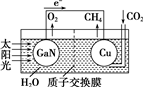 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是阳极 | |
| C. | 铜电极表面的电极反应式为CO2+8e-+8H+═CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
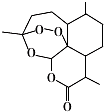
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素分子结构稳定,受热不易分解 | |
| C. | 青蒿素中含多个环状结构,其中有一个六元碳环 | |
| D. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
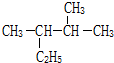 的系统命名为2,3-二甲基戊烷.
的系统命名为2,3-二甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 | |
| B. | 用一定量的锌片和足量的稀硫酸反应制氢气时,加入少量氧化铜,可以加快反应的速率且生成氢气的总量不变 | |
| C. | 燃烧一定是放热反应,也是氧化还原反应 | |
| D. | 化学反应中能量变化的大小与反应物的状态无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com