
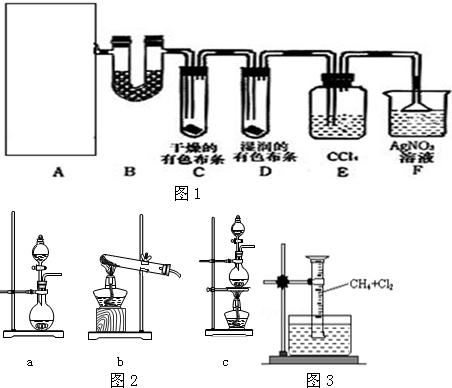
分析 根据元素的种类由质子数决定分析,根据质子数、中子数和核数、同位素的概念判断,具有相同质子数,不同中子数同一元素的不同核素互为同位素.
解答 解:元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称,不同种元素最本质的区别是质子数不同,元素的种类由质子数决定,11H、12H、13H的质子数都是1,所以3种不同粒子${\;}_{1}^{1}H$、${\;}_{1}^{2}H$、${\;}_{1}^{3}H$表示同一种元素氢元素;${\;}_{6}^{14}C$表示碳元素,${\;}_{53}^{125}I$表示碘元素,故总共有3种元素;
核素是指具有一定数目质子和一定数目中子的一种原子;11H、12H、13H的质子数都是1,中子数分别为0、1、2,属于三种核数,;${\;}_{6}^{14}C$表示碳的一种核素,${\;}_{53}^{125}I$表示碘元素的一种核素,故总共有5种核素;
具有相同质子数,不同中子数同一元素的不同核素互为同位素;11H、12H、13H的质子数都是1,中子数分别为0、1、2,属于同位素;
故答案为:3;5;同位素.
点评 本题主要考查的是元素的概念、核素的概念以及同位素的概念,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 二 | ⑪ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
; ;用电子式表示元素②与⑪化合物的形成过程
;用电子式表示元素②与⑪化合物的形成过程 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
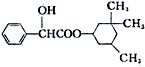 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ②③④⑤⑥⑦⑧ | C. | ②④⑦ | D. | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有达到平衡时,消耗O2的速率与生成NO的速率之比才为5;4 | |
| B. | 若单位时间生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 | |
| C. | 达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量保持不变 | |
| D. | 达到平衡状态时,若增加容器体积,则反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③ | C. | ①② | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com