
| A、BaSO4悬浊液中存在平衡:BaSO4(aq)?Ba2+(aq)+SO42-(aq) | ||||
B、向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O
| ||||
C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO
| ||||
D、铝热反应的原理为:Al2O3+2Fe
|


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
| A、含1mol硅原子的SiO2晶体中Si-O键的个数为2NA |
| B、理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为NA |
| C、标准状况下,11.2 L氯仿中含有的C-Cl键的数目为1.5NA |
| D、15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu粉反应:Cu+2Fe3+=Cu2++2Fe2+ | ||||
B、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| C、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | ||||
| D、往氯化铝溶液中滴加过量的氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
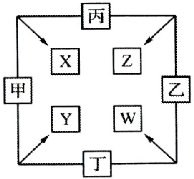 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如图.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1 | 4 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.80L |
| B、5.60L |
| C、11.2L |
| D、16.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol-OH中含有的质子数为9NA |
| B、lmol2,3-丁二醇分子中含C一C数目为4NA |
| C、1 L 1 mol.L-1 FeCl3 溶液中含有 Fe3+ 数为 NA |
| D、71 g氯气参与反应,电子转移数目一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、遇pH试纸变红色的溶液中:K+、Cl-、NO3-、NH4+ | ||
| B、在c(H+)/c(OH-)=1×1012的溶液中:I-、Cl-、HCO3-、Na+ | ||
C、在c(H+)=
| ||
| D、由水电离出的c(H+)=1×10-12mol?L-1的溶液中:NH4+、Fe2+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com