
下列实验能达到相应目的的是
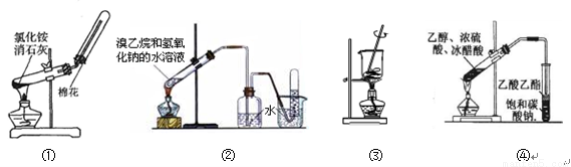
A.用图①装置制取并收集氨气 B.用图②装置制取和收集乙烯
C.用图③装置将海带灼烧成灰 D.用图④装置制取乙酸乙酯
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如
图所示。下列说法不正确的是

A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A、将Al条投入NaOH溶液中:Al+OH-+H2O === AlO +H2↑
+H2↑
B、铜溶于稀硝酸中:Cu+4H++2NO === Cu2++2NO2↑+2H2O
=== Cu2++2NO2↑+2H2O
C、碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO +OH- === CO
+OH- === CO +H2O
+H2O
D、向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:
CO +CH3COOH === CH3COO-+HCO
+CH3COOH === CH3COO-+HCO
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:选择题
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | SO2和氯水有漂白性 | 两者都能使溴水褪色 |
B | 用淀粉-KI鉴别FeCl2 | Fe2+有氧化性 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)香兰素( )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:
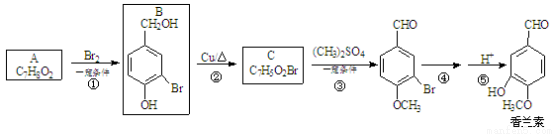

(1)写出A的结构简式 ,反应③的反应类型是______________。
(2)写出反应④的化学方程式_______________________________(不用注明条件)。
(3)1 mol香兰素在一定条件下与H2发生反应,最多消耗H2_________mol。
(4)D与香兰素互为同分异构体,能与NaHCO3溶液反应放出气体,遇FeCl3溶液显紫色,且苯环上的一氯取代物只有2种,请写出D的结构简式____ __ ___。
(5)香兰素的另一种同分异构体结构简式为 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_____ _____。
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_____ _____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:填空题
(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液: Na+、K+、C6H5O-、HCO3-
B.0.1mol?L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl-
C.0.1mol?L-1FeCl3 溶液:K+、NH4+、I-、SCN-
D.使甲基橙变红色的溶液: K+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:填空题
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
下列有关金属的说法正确的是
A.金属原子的核外电子在金属晶体中都是自由电子
 B.镁型和铜型的原子堆积方式空间利用率最高
B.镁型和铜型的原子堆积方式空间利用率最高
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.温度升高,金属的导电性将变强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com