
分析 (1)①根据信息确定化学反应的反应物和生成物,进而书写化学方程式;
②根据影响化学反应速率的外界因素可知,提高温度、增大反应物浓度、增大反应物接触面积等,都可以提高反应速率;
③利用盖斯定律来计算化学反应的焓变;SO2是酸性氧化物,能与氨水、碳酸钠等物质反应,但不能与氯化钡反应,据此答题;
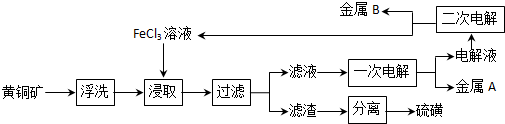
(2)黄铜矿(主要成分CuFeS2,铁为+2 价),只考虑黄铜矿中CuFeS2 参与反应,用氯化铁溶液浸取,得到含有Cu 2+、Fe 2+的溶液和硫沉淀,电解含有Cu 2+、Fe 2+的溶液得金属A为铜,所得电解液为FeCl2溶液,经二次电解可知金属B为铁和氯化铁溶液,FeCl3 溶液能全部获得再生以供循环使用,据此答题;
解答 解:(1)①根据信息:“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS)和SO2,知道反应物是黄铜矿和氧气,产物是Cu2S和FeS,反应的化学方程式为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S(s)+2FeS+SO2,
故答案为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S(s)+2FeS+SO2;
②根据影响化学反应速率的外界因素可知,为加快黄铜矿焙烧速率,可采取的措施有将黄铜矿粉碎、升高温度、增大空气流速,
故答案为:将黄铜矿粉碎、升高温度、增大空气流速;
③已知:A、2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,B、2Cu2O(s)+Cu2S (s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)可以是$\frac{1}{3}$ (A+B),即△H=$\frac{1}{3}$×(116.0kJ•mol-1-768.2kJ•mol-1)=-217.4 kJ•mol-1,处理SO2的方法中a.将反应炉建高,采取高空排放,仍然会污染空气,故a错误;
b.用纯碱溶液吸收,二氧化硫与碳酸钠反应制备亚硫酸钠,故b正确;
c.用氨水吸收后,生成亚硫酸铵,再经氧化制备硫酸铵,故c正确;
d.二氧化硫不与用BaCl2 溶液反应,所以不能制备BaSO3,故d错误,故选bc,
故答案为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4 kJ•mol-1 ;bc;
(2)黄铜矿(主要成分CuFeS2,铁为+2 价),只考虑黄铜矿中CuFeS2 参与反应,用氯化铁溶液浸取,得到含有Cu 2+、Fe 2+的溶液和硫沉淀,电解含有Cu 2+、Fe 2+的溶液得金属A为铜,所得电解液为FeCl2溶液,经二次电解可知金属B为铁和氯化铁溶液,FeCl3 溶液能全部获得再生以供循环使用,
①根据上面的分析可知,在“FeCl3溶液浸出工艺”中,“浸出”反应的离子方程式为CuFeS2+4Fe3+═Cu2++5Fe2+2S,
故答案为:CuFeS2+4Fe3+═Cu2++5Fe2+2S;
②“一次电解”时,阳极上亚铁离子失电子生成铁离子,电极反应式为Fe2+-e-═Fe3+,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e-═Cu,
故答案为:Fe2+-e-═Fe3+;Cu2++2e-═Cu;
③一次电解时生成铜的电极反应式为Cu2++e-═Cu,二次电解生成铁的电极反应式为Fe2++e-═Fe,两次电解过程通过电路的电子数相等,铜与铁的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查了黄铜矿的加工方法,试题涉及了化学式的书写、热化学方程式的书写、物质的分离与提纯、离子方程式的书写、电化学、化学反应速率等知识,注意知识的归纳和整理是解题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 同一主族元素的原子序数的差不可能为10 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 过渡元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8(>8溶解) | 9(>9溶解) |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
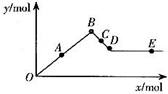 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A. | A~D时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | C~D时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | A~D时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | D~E时溶液中离子的物质的量:Ba2+可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
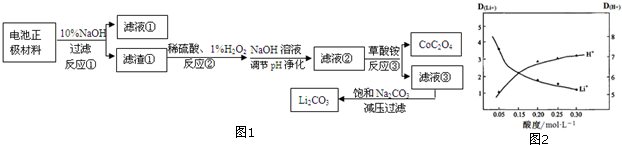
| 弱电解质 | CoC2O4 | Fe(OH)3 | NH3•H2O | H2C2O4 |
| 平衡常数 | Ksp=6.3×10-8 | Ksp=2.79×10-39 | Ka=1.7×10-5 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 CH2-CHCl
CH2-CHCl .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液pH≤2时,生铁发生吸氧腐蚀 | |
| B. | 在酸性溶液中生铁只能发生析氢腐蚀 | |
| C. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| D. | 两溶液中负极反应均为Fe-2e-=Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com