
由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完.试计算:
(1)产生这些气体消耗了多少克锌
(2)有多少个电子通过了导线
(3)200mL稀H2SO4的物质的量浓度是多少.
考点: 化学方程式的有关计算.
分析: 该原电池中,锌电极上电极反应式为Zn﹣2e﹣=Zn2+,铜电极上电极反应式为2H++2e﹣=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)根据氢气和锌之间的关系式计算锌的质量;
(2)根据氢气和转移电子之间的关系式计算转移电子的物质的量;
(3)根据氢原子守恒计算硫酸的浓度.
解答: 解:该原电池中,锌电极上电极反应式为Zn﹣2e﹣=Zn2+,铜电极上电极反应式为2H++2e﹣=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)设参加反应的Zn的质量为x,
Zn+2H+=H2↑+Zn2+
65g 22.4L
x 3.36L
则x=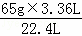 =9.75g
=9.75g
答:消耗锌的质量9.75g;
(2)设转移电子的物质的量为y,
Zn+2H+=H2↑+Zn2+转移电子
22.4L 2mol
3.36L y
y=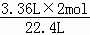 =0.30mol,
=0.30mol,
答:通过电子的物质的量为0.30mol;
(3)根据氢原子守恒得H2SO4~H2,则c(H2SO4)=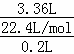 =0.75 mol•L﹣1,
=0.75 mol•L﹣1,
答:原硫酸的浓度为0.75 mol•L﹣1.
点评: 本题以原电池原理为载体考查了物质的量的有关计算,根据各个物理量之间的关系来分析解答,题目难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. |
|
|
| B. | 不同元素的原子构成的分子只含极性共价键 |
|
| C. |
|
|
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是()
①w=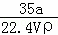 ×100%
×100%
②c=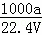
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A. ①③ B. ②③ C. ①② D. 只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是()
A. 所有主族元素正化合价数,等于它的族序数
B. ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C. ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D. 前三周期元素中共有非金属元素12种
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应热现象,正确的说法是()
A. 放热的反应发生时不必加热
B. 化学反应一定有能量变化
C. 化学反应一般地说,吸热反应需要加热后才能发生
D. 化学反应热效应数值与反应物质多少无关
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中错误的是()
A. 进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干
B. 进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 浓NaOH溶液与浓CaCl2溶液混合:Ca2++2OH﹣=Ca(OH)2↓
B. 氯化铝溶液中滴加氨水生成沉淀:Al3++3OH﹣=Al(OH)3↓
C. 利用醋酸溶解含碳酸钙的水垢CaCO3+2H+=Ca2++H2O+CO2↑
D. NaHSO4溶液中滴加NaHCO3溶液:2H++CO32﹣=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
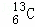 ﹣NMR(核磁共振)可用于含碳化合物的结构分析,
﹣NMR(核磁共振)可用于含碳化合物的结构分析,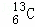 表示的是()
表示的是()
A. 核外有13个电子,其中6个能参与成键
B. 核内有6个质子,核外有7个电子
C. 质量数是13,原子序数是6,核内有7个质子
D. 质量数是13,原子序数是6,核内有7个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
用10mL的0.1mol•L﹣1 BaCl2溶液恰好可使相同体积的硫酸铁(Fe2(SO4)3)、硫酸锌(ZnSO4)和硫酸钾(K2SO4)三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是()
A. 3:2:2 B. 1:2:3 C. 1:3:3 D. 3:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com