
【题目】(1)写出次氯酸的结构式________;
(2)NaHCO3的俗名是_______;
(3)第四周期第ⅦA原子序数为______,元素符号为_________,其最高价氧化物的水化物化学式为_______;
(4)写出工业上制氯气的离子方程式_______。
【答案】H-O-Cl 小苏打 35 Br HBrO4 2Cl- + 2H2O![]() 2OH -+ Cl2↑+ H2↑
2OH -+ Cl2↑+ H2↑
【解析】
(1)次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共价键;
(2)NaHCO3为碳酸氢钠的化学式;
(3)第四周期0族元素的原子序数为36,据此分析解答;
(4)工业上通过电解饱和食盐水制备氯气,据此书写反应的离子方程式。
(1)次氯酸是共价化合物,氧原子和氢原子、氯原子分别形成一个共价键,结构式为:H-O-Cl,故答案为:H-O-Cl;
(2)碳酸氢钠俗称小苏打,故答案为:小苏打;
(3)第四周期0族元素的原子序数为36,则元素周期表中第四周期,第ⅦA族元素的原子序数为35,为溴元素,元素符号为Br,最高价氧化物对应的水化物为HBrO4,故答案为:35;Br;HBrO4;
(4)工业上通过电解饱和食盐水制备氯气,反应的离子方程式为2Cl- + 2H2O![]() 2OH -+ Cl2↑+ H2↑,故答案为:2Cl- + 2H2O
2OH -+ Cl2↑+ H2↑,故答案为:2Cl- + 2H2O![]() 2OH -+ Cl2↑+ H2↑。
2OH -+ Cl2↑+ H2↑。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】液相催化还原法去除水体中![]() 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂Pd-Cu/TiO2的制备和催化条件,结果如下。
Ⅰ.制备Pd-Cu/TiO2的反应过程如下图所示,光照使TiO2发生电荷分离,将金属Pd沉积在TiO2表面。再用类似方法沉积Cu,得到在TiO2纳米颗粒表面紧密接触的Pd-Cu纳米簇。
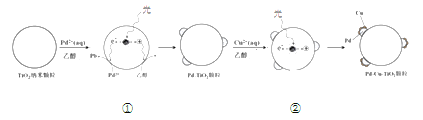
(1)该过程中,乙醇发生__________(填“氧化”或“还原”)反应。
(2)请在②中补全光照条件下形成Pd-Cu纳米簇的反应过程示意图_______。
Ⅱ.Pd-Cu/TiO2分步催化还原机理如图a所示。其他条件相同,不同pH时,反应1小时后![]() 转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
转化率和不同产物在总还原产物中所占的物质的量的百分比如图b所示。
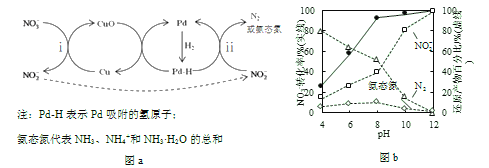
(3)该液相催化还原法中所用的还原剂是__________。
(4)i的离子方程式是__________。
(5)研究表明,OH–在Pd表面与![]() 竞争吸附,会降低Pd吸附
竞争吸附,会降低Pd吸附![]() 的能力,但对Pd吸附H的能力影响不大。
的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是____________,导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中![]() 的变化趋势是__________,说明Pd表面吸附的
的变化趋势是__________,说明Pd表面吸附的![]() 和H的个数比变大,对反应__________(用离子方程式表示)更有利。
和H的个数比变大,对反应__________(用离子方程式表示)更有利。
(7)使用Pd-Cu/TiO2,通过调节溶液pH,可将![]() 尽可能多地转化为N2,具体方法是__________。
尽可能多地转化为N2,具体方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.地球上最基本的能源是太阳能,大自然中利用太阳能最成功的是植物的光合作用
B.将植物的秸秆等加入沼气发酵池中,在富氧条件下,经过沼气细菌的作用,生成沼气
C.水煤气经过催化合成可以得到甲醇等燃料
D.贮氢合金并不是简单的吸附氢气,而是通过化学反应贮存氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g
B.25℃、101.3kPa时,11.2LH2中含有的原子数为NA
C.10 mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.1mol/L Na2SO4溶液中离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面物质间转换的框图,回答有关问题:
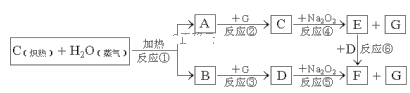
(1)写出框图中物质A和F指代物质的化学式:A___,F___;
(2)在反应①~⑥中属于非氧化还原反应的是___(填写序号);
(3)如果2molNa2O2与足量水蒸气反应生成O2,该反应中转移电子总数是___;
(4)如果A、B混合气体3.0g(平均摩尔质量15g·mol-1),在与G充分反应后,通过足量Na2O2,可使Na2O2增重___g,并得到O2___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
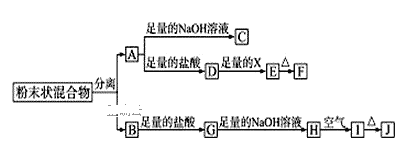
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用碱性溶液吸收多余的氯气,防止环境污染。某次实验中,将多余的氯气用100 mL 2.00 mol·L1的NaOH溶液恰好完全吸收,测得吸收液中ClO与ClO3的物质的量之比为5:1。
(1)吸收的氯气的物质的量为_____________。
(2)吸收液中Cl的物质的量浓度为______________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐在无机试剂制备中应用广泛。某研究小组用如下两种方法制备FeCO3。已知: FeCO3 是白色固体,难溶于水。
I.研究小组用炼铁厂的铁矾渣制备FeCO3,铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等。
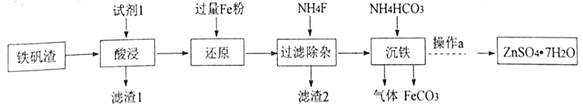
(1)试剂1是过量的_______,滤渣 2的成分是__________ (写化学式);
(2)“沉铁”发生反应的离子方程式是____________;
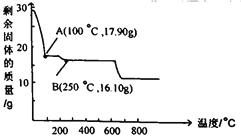
(3)沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),“操作a”是__,取28.70g皓矾(ZnSO4·7H2O)加热,剩余固体的质量变化如图,100°C时所得固体的化学式____。
II.研究小组又采用如下装置制取FeCO3 (C后及夹持装置略)。操作的关键是向Na2CO3溶液(pH=12.11)通入一段时间CO2至溶液pH为7,再滴加一定量FeSO4溶液,产生白色沉淀。
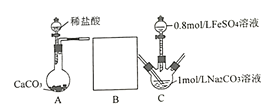
(1)画出装置B______________,B中所用试剂为______________;
(2)先向1mol/L Na2CO3溶液中通入CO2的目的是_________________________;
(3)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是_______________(不考虑操作不当引起的误差)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
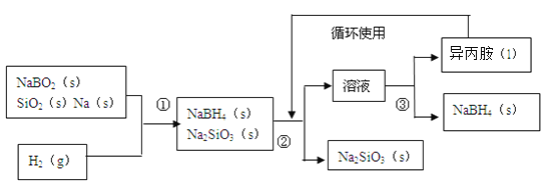
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:□NaBO2+□SiO2+□Na+□H2=□NaBH4+□Na2SiO3 ______________
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101kPa下,已知每消耗3.8克NaBH4(s)放热21.6kJ,该反应的热化学方程式是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com