
【题目】HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+ . AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是(填序号).
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是(填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方式: .
(4)Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要
求产物纯净,可选用的最佳试剂是(填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+K2O2→ K2FeO4+K2O+K2SO4+O2↑
当转移了1.5NA个电子时,在标况下可收集到 L氧气.
【答案】
(1)D
(2)B
(3)NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣
(4)c
(5)6;2;2;2;1;3.36
【解析】解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+ , Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+ , 说明亚硝酸盐具有氧化性被还原,在反应中为氧化剂,所以维生素C是还原剂,
所以答案是:D;(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1﹣4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2﹣+2I﹣+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
所以答案是:B;(3)观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣ ,
所以答案是:NO2﹣+Cl2+H2O=NO3﹣+2H++2Cl﹣;(4)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选c;
故选:c;(5)根据方程式可知,铁元素的化合价从+2价升高到+6价,失去4个电子;氧元素的化合价从﹣1价升高到0价,失去1个电子,氧元素的化合价从﹣1价降低到﹣2价,得到1个电子,最小公倍数是8,所以硫酸亚铁前面配2,K2O2前面配6,再根据质量守恒配平其他物质,配平后的方程式为:2FeSO4+6K2O2═2K2FeO4+2K2SO4+2K2O+O2;由反应方程式可知转移10NA个电子,生成22.4L的氧气,转移了1.5NA个电子时,在标况下可收集到 ![]() ×22.4L=3.36L;
×22.4L=3.36L;
所以答案是:2、6、2、2、2、1;3.36.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意图如下,下列说法中正确的是
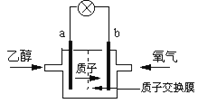
A.b极为电池的负极
B.电池工作时电子在内电路中由a极经溶液到b极
C.电池负极的电极反应为:C2H5OH+3H2O-12e-=2CO2+12H+
D.电池工作时,1mol乙醇被氧化时有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化中,不能通过—步化学反应实现的是
A. Fe—Fe3O4 B. C2H2—CO2 C. CH2=CH2→CH3CH3 D. A12O3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2SO3及其钠盐的溶液中,H2SO3、HSO3-、SO32-的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
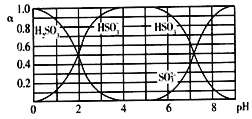
A. 溶液的pH=5时,硫元素的主要存在形式为HSO3-
B. 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-)
C. 向pH=8的上述溶液中滴加少量澄清石灰水, 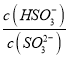 的值增大
的值增大
D. 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水溶液中有不同的性质。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有_____________。
a.溶液中氢氧离子浓度 b.氨水的电离程度c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________________(填“相同”或“不相同”),其原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.多糖、油脂、蛋白质均为高分子化合物
B.淀粉和纤维素水解的最终产物均为葡萄糖
C.可用酸性 KMnO4 溶液鉴别苯和环己烷
D.分离溴苯和苯的混合物:加入 NaOH 溶液分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3 , 还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程: 
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O═Na2Al2Si2O8↓+4NaOH 赤泥的主要成分为(写出化学式).
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3 , 滤液的主要成分为(写出化学式).实验室过滤需用到的玻璃仪器有烧杯、、玻璃棒.
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 .
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如表所示. (已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com