
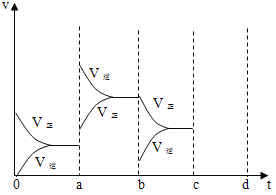
【题目】(1)下图表示在密闭容器中反应:2SO2+O2 ![]() 2SO3 △H =-Q kJ/mol 到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是_____;b→c 过程中改变的条件可能是_____; 若增大压强时,将反应速度变化情况画在 c~d 处____________。
2SO3 △H =-Q kJ/mol 到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b 过程中改变的条件可能是_____;b→c 过程中改变的条件可能是_____; 若增大压强时,将反应速度变化情况画在 c~d 处____________。
(2)可逆反应 mA(g)+nB(g)![]() pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
pC(g)达到平衡后,升高温度,B 的转化率变大;当减小压强,C 的体积分数减小。
①用“>”、“=”或“<”填空:该反应的Δ H_____0,m+n_____p。
②用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入 B,则 A 的转化率_____;升高温度,则平衡时 B、C 的浓度之比 c(B)/c(C)将_____;加入催化剂,平衡时气体混合物的总物质的量_____。
③若 A、C 均为无色气体,B 为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入 C,平衡混合物的颜色_____;而恒压充入氖气,平衡混合物颜色_____。
【答案】升温减小 SO3 浓度 >>增大减小 不变变深变浅
>>增大减小 不变变深变浅
【解析】
(1)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图像应为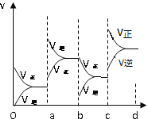 ;故答案为:升高温度;降低产物SO3浓度;
;故答案为:升高温度;降低产物SO3浓度; ;
;
(2)①当升高温度时,B的转化率变大,说明平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应是吸热反应,减小压强时,混合体系中C的质量分数也减小,平衡向逆反应移动,减小压强平衡向气体体积增大的方向移动,即m+n>p,故答案为:>;>;
②加入B(体积不变),平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,则A的转化率增大,升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大,所以则平衡时B、C的浓度之比![]() 将减小,催化剂不影响化学平衡状态,所以平衡时气体混合物的总物质的量不变,故答案为:增大;减小;不变;
将减小,催化剂不影响化学平衡状态,所以平衡时气体混合物的总物质的量不变,故答案为:增大;减小;不变;
③加入C(体积不变)时,平衡向逆反应方向进行,B的浓度增大,颜色变深;维持容器内压强不变,充入氖气,容器体积增大,B的浓度降低,颜色变浅,故答案为:变深;变浅。


科目:高中化学 来源: 题型:
【题目】某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是 ( )
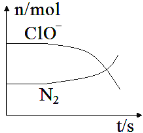
A. 该反应中Cl-为还原产物
B. 氧化剂与还原剂物质的量比为3:2
C. 消耗1 mol还原剂,转移6 mol电子
D. 氧化性:ClO-比 N2强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量均为mg的Na2CO3、NaHCO3固体混合物,加热第一份充分反应得到CO2质量是x g,向加热后所得固体中加入足量的盐酸得到CO2 a g;向第二份中直接加入足量盐酸得到CO2的质量是bg。则x等于
A.2aB.2bC.b-2aD.b-a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒沙特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①漏斗、②冷凝管、③蒸馏烧瓶、④玻璃棒、⑤分液漏斗、⑥锥形瓶,其中蒸馏操作不需要的仪器是( )
A.①③④B.①②⑥C.①④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列六组物质:属于同系物的是_________,属于同分异构体是_________,属于同种物质的是___________。(填序号)

(2)下列实验设计或操作合理的是_______________。
a.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
b.只用水就能鉴别苯、硝基苯、乙醇;
c.实验室通过浓硫酸与乙醇反应制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度;
d.将电石与饱和食盐水反应后,直接通入酸性KMnO4溶液检验是否得到乙炔。
(3)按要求书写:
①乙炔的电子式______;②  的系统命名为___________________。
的系统命名为___________________。
③相对分子质量为72且沸点最低的烷烃的结构简式___________________;
④某单烯烃的相对分子质量为84,若该分子内所有碳原子均在同一平面内,则其结构简式为_______________。
⑤C4H10O的同分异构体中,属于醇类且含有“手性碳原子”的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
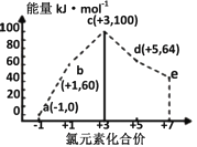
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com