
| A. | 1s22s22p3 | B. | 1s22s22p63s23p63d34s2 | ||
| C. | 1s22s22p63s23p6 | D. | 1s22s22p5 |
分析 由电子排布可知,A、D元素均为主族元素,主族元素的最外层电子数等于其最高正化合价,C为稀有气体,其化合价一般看做0,B为副族元素,其最高正价与外围电子有关,据此分析.
解答 解:A.1s22s22p3为N元素,其最高正价为+5价;
B.1s22s22p63s23p63d34s2为V元素,外围电子数为5,其最高正价为+5价;
C.1s22s22p63s23p6为Ar元素,属于稀有气体,其化合价一般看做0;
D.1s22s22p5为F元素,F没有最高正价;
所以化合价最高的是AB.
故选AB.
点评 本题考查电子排布及元素的性质,注意元素的推断是解答的关键,注意把握电子排布与化合价的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 使用pH试纸测定溶液pH时若先润湿,测得溶液的pH一定有影响 | |
| B. | 25℃时,水溶液中水电离出的c(H+)和水电离的c(OH-)乘积一定等于10-14 | |
| C. | 如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡 | |
| D. | 温度保持不变,向水中加入醋酸钠固体一定会影响水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1molNa2O2固体跟足量CO2气体完全反应,转移NA个电子 | |
| C. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| D. | 100mL 0.1mol/L盐酸中含HCl分子数为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中H+、NH4+、NO3-、Cl-可以大量共存 | |
| B. | Cu(NH3)4SO4中呈正四面体的原子团只有SO42- | |
| C. | 滴加Na2CO3溶液产生CuCO3蓝色沉淀 | |
| D. | 硫酸铜溶液与氨水作用后可缓缓加入乙醇可产生晶体,其产生晶体的主要原理是CuSO4+4NH3═[Cu(NH3)4]SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
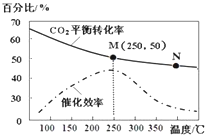
| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 化学平衡常数:KN>KM | |
| C. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
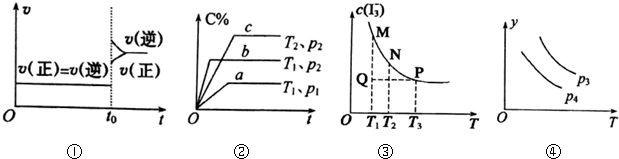
| A. | 图①对于达到平衡状态的N2(g)+3H2(g)?2NH3(g),在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 图②p2<p1,T1<T2 | |
| C. | 图③是反应:I2(aq)+I-(aq)?I3-(aq)的平衡体系中,I3-的物质的量浓度与温度(T)的关系图(曲线上的任何一点都代表平衡状态):Q点时,v正>v逆 | |
| D. | 图④对于反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Z的百分含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com