
| A. | 澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| B. | 过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 氧化亚铁溶于稀盐酸:FeO+2H+=Fe2++H2O | |
| D. | 氢氧化钡溶液中加过量小苏打:Ba2++OH-+HCO3-=BaCO3↓+H2O. |
分析 A.二氧化碳过量反应生成碳酸氢钙;
B.不符合反应客观事实,过量的氨水滴加到氯化铝溶液生成氢氧化铝和氯化铵;
C.氧化亚铁溶于稀盐酸反应生成氯化亚铁和水;
D.不符合反应客观事实,碳酸氢钠过量,反应生成碳酸钡、碳酸钠和水.
解答 解:A.澄清石灰水中通入过量二氧化碳F反应生成碳酸氢钙,离子方程式:OH-+CO2=HCO3-,故A错误;
B.过量的氨水滴加到氯化铝溶液反应生成氢氧化铝沉淀和氯化铵,离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.氧化亚铁溶于稀盐酸反应生成氯化亚铁和水,离子方程式:FeO+2H+=Fe2++H2O,故C正确;
D.氢氧化钡溶液中加过量小苏打,反应生成碳酸钡沉淀、碳酸钠和水,离子方程式:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,注意反应物用量对反应的影响是解题关键,选项D为易错选项.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰升华--共价键 | B. | 二氧化硅熔融--分子间作用力 | ||
| C. | 氢氧化钠熔融--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ra是第七周期、IIA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强 | |
| B. | 已知As是第四周期、VA族的元素,故AsH3 的稳定性比NH3的稳定性强 | |
| C. | 已知Cs原子半径比Na的原子半径大,故Cs与水反应比Na与比反应更剧烈 | |
| D. | 已知Cl与Al处于同一周期,且Cl的核电荷数比Al的核电荷数大,故Cl的原子半径比Al的原子半径小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 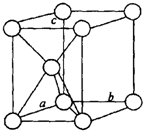 | (1)镁原子在二维空间的配位数为6 |
| (2)位于晶胞中部的鎂原子与离它最近两平面相切(填“相离”或“相切”或”相交”) | |
| (3)请用含R1、NA的数学式子表达金属镁的密度:$\frac{3\sqrt{2}}{{{R}_{1}}^{3}{N}_{A}}$g/cm3(根号带在分子上) | |
 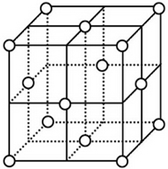 | (4)铜原子在三维空间的配位数为12 |
| (5)晶胞中面心上的六个铜原子构成的空间几何体名称为正八面体 | |
| (6)请用含R2、NA的数学式子表达金属铜的密度:$\frac{8\sqrt{2}}{{N}_{A}{{•R}_{2}}^{3}}$g/cm3(根号带在分子上) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
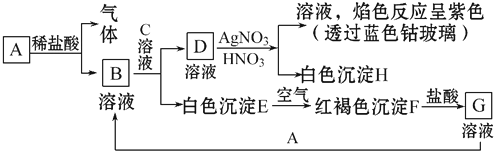
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
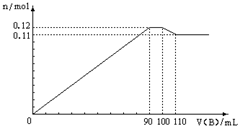 向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:
向100mLBaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀和加入混合溶液B的体积关系如下图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com