
【题目】反应 C(s)+ H2O (g) ![]() CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( )
CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( )

A.CO的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段H2的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动
【答案】B
【解析】
该反应为气体体积减小的反应,且为放热反应,由图象可知,t1时正逆反应速率均增大,且逆反应速率大于正反应速率,则平衡逆向移动;t3时正逆反应速率同等程度的增大,t4时正逆反应速率均减小,但逆反应速率大于正反应速率,则化学平衡逆向移动,结合外因对速率与化学平衡的综合影响效果分析作答。
A.由上述分析可知,t3时平衡不移动,t1、t4时改变条件反应均逆向移动,氨气的含量减少,则氨气的体积分数最高的一段时间为t0-t1,A项错误;
B.t2-t3达到化学平衡状态,体积分数不变,t3-t4时间段化学平衡不移动,所以氨气的体积分数相等,B项正确;
C.t1时正逆反应速率均增大,且逆反应速率大于正反应速率,平衡逆向移动,改变条件为降低压强,而降低温度平衡会向正向移动,不符合图示信息,C项错误;
D.t4-t5时间段,逆反应速率大于正反应速率,则化学平衡向逆反应方向移动,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比是1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2NH![]() =Mg2++2NH3·H2O
=Mg2++2NH3·H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:CO![]() +2CH3COOH=2CH3COO-+H2O+CO2↑
+2CH3COOH=2CH3COO-+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不饱和聚酯(UP)![]() 是生产复合材料“玻璃钢”的基体树脂材料。如图是以基础化工原料合成UP流程:
是生产复合材料“玻璃钢”的基体树脂材料。如图是以基础化工原料合成UP流程:
![]()
下列说法不正确的是( )
A.丙可被KMnO4酸性溶液直接氧化制单体1
B.单体2可能是乙二醇
C.单体1、2、3经缩聚反应制得UP
D.调节单体的投料比,控制m和n的比值,获得性能不同的高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用实验I验证Fe2(SO4)3与Cu的反应,观察到了异常现象,决定对其进行深入探究。
实验I:
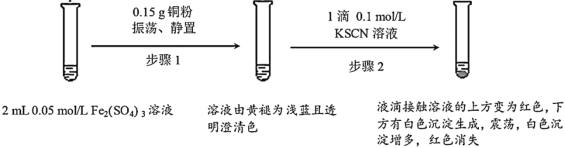
(1)Fe2(SO4)3溶液常温下呈酸性的原因是___。
(2)Fe2(SO4)3与KSCN溶液反应的离子方程式为___。
(3)实验前,小组同学预测经过步骤2后溶液不应该呈现红色,依据是__。
(4)实验小组对白色沉淀的产生进行了深入探究
查阅资料:i.CuSCN为难溶于水的白色固体。
ii.SCN-被称为拟卤素离子,性质与卤素离子相似
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能
猜测1:Cu2+与KSCN发生了氧化还原反应
猜测2:亚铁离子将其还原Cu2++Fe2+=Cu++Fe3+,Cu++SCN-=CuSCN↓
为证实猜想小组同学做了实验II和III。(FeSO4和CuSO4溶液浓度为0.1mol/L,KSCN溶液浓度为0.4mol/L)
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
II |
| 加入1mLKSCN溶液 | 开始时溶液的上方变为红色,一段时间后红色向下蔓延,最后充满整支试管 |
| 加入1mLKSCN溶液 | 溶液变成绿色 |
①猜测1的离子方程式____;
②实验II中试管__(填字母)中的现象可以证实猜测1不成立。
实验序号 | 对比实验及试剂 | 实验步骤 | 实验现象 |
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈红色 | ||
| 加入4mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈浅红色 | ||
| 加入2mLCuSO4溶液 | 溶液变为淡蓝色 | |
再加入1mLKSCN溶液 | 溶液的上层变为红色,有白色沉淀产生,一段时间后整支试管溶液呈深红色 |
(5)Fe3+的氧化性本应强于Cu2+,结合实验III中的现象解释Cu2++Fe2+=Cu++Fe3+能正向发生的原因是___。
(6)实验小组查阅资料并讨论后得出:溶液中离子在反应时所表现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使Cu2+的氧化性增强,并补充实验进一步证明。补充的实验是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是质子数依次增大的短周期主族元素,它们形成的某种化合物Q的结构式如图所示。X与W形成的化合物M常温下是液体。下列说法正确的是
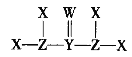
A.X与Z可形成质子数、电子数均相同的ZX3、![]()
B.M热稳定性强且具有弱氧化性
C.Q分子中各原子最外电子层均达到稳定结构
D.X、Y、Z、W四种元素间只能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A,B分别为0.6mol和0.5mol,在0.4L密闭容器中发生反应:3A+B![]() aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
aC+2D,经5min后,此时气体C为0.2mol;又知在此反应时间内,D的平均反应速率为0.1mol/(L·min),下面的结论正确的是( )
A.此时,反应混合物总物质的量为1molB.B的转化率40%
C.A的平均反应速率为0.1mol/(L·min)D.a值为2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com