
【题目】实现下列变化,需克服相同类型作用力的是
A.干冰和碘的升华B.冰的融化和水的分解
C.NaCl和HCl溶于水D.石英和氯化钠分别受热熔化
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是( )
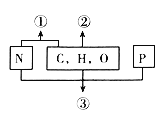
A. 若①是某种大分子的基本组成单位,则①是氨基酸
B. 若②是生命活动的主要能源物质,则②是糖类
C. 若②是细胞中的储能物质,则②一定是脂肪
D. 若③是携带遗传信息的大分子物质,则③一定是核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。

(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=![]() ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。

①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。

我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1,N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。则相同条件下破坏1molNO中化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=____ kJ·mol-1;若加入少量NaOH固体,则溶液中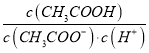 _____(填“增大”、“减小”或“不变”)。
_____(填“增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
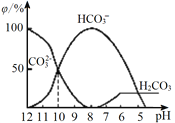
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______。
HCO3-+OH-的平衡常数Kh=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应中能量变化的说法正确的是
A.断开化学键会释放能量B.氧化还原反应均为放热反应
C.化学反应过程中一定伴有能量变化D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1 mol HNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是

A. b表示Fe3+物质的量的变化线
B. n1=0.8
C. P点时,n(Fe2+)=0.45mol
D. 加入的铁为n3mol时,再向溶液中加入铜粉,铜粉可以溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com