
| A. | 原子半径 C>D>B>A | B. | 原子序数 a>b>d>c | ||
| C. | 离子半径 A>B>D>C | D. | 元素失电子能力 A>B>D>C |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,则原子序数:a>b>d>c,且A、B在周期表中C、D的下一周期,A、B为金属,C、D为非金属,同周期自左而右原子半径减小、同主族自上而下原子半径增大,电子层结构相同,核电荷数越大离子半径越小,金属性越强,元素原子失去电子的能力越强.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,则原子序数:a>b>d>c,且A、B在周期表中C、D的下一周期,A、B为金属,C、D为非金属.
A.A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,同周期自左而右原子半径减小、同主族自上而下原子半径增大,则有原子半径:B>A>C>D,故A错误;
B.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+3=d+1,则原子序数:a>b>d>c,故B正确;
C.电子层结构相同,核电荷数越大离子半径越小,核电荷数a>b>d>c,故离子半径:C>D>B>A,故C错误;
D.同周期自左而右金属性减弱,金属性越强,元素原子失去电子的能力越强,元素失电子能力:B>A>C>D,故D错误,
故选B.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,也可以确定具体的元素,清楚元素周期律的递变规律是解答该题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
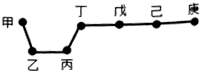 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 庚的最高价氧化物的水化物酸性最强 | |
| D. | 乙、丙、丁的最高价氧化物的水化物可以以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
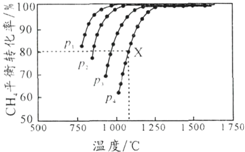 向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
向密闭容器中充入物质的量浓度均为 0.1mol/L的CH4和 CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | 平衡时CO与H2的物质的量比为1:1 | |
| B. | p1、p2、p3、p4由小到大的顺序为p1<p2<p3<p4 | |
| C. | 1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2)=0.008 mol•L-1•min-1 | |
| D. | 随着温度升高,该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )| A. | 共价键 | B. | 离子键 | C. | 配位键 | D. | 范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某可逆反应达平衡状态时反应物和生成物共存 | |
| B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2与2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| C. | 对于可逆反应,加入催化剂可使正逆反应速率均增大 | |
| D. | 提高可逆反应的限度可增加产量,从而提高经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A-N+m)mol | B. | $\frac{a}{Am}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N)mol | D. | $\frac{a}{A}$(A-N+m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
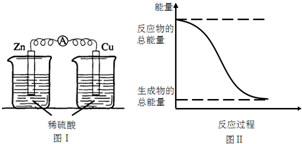
| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
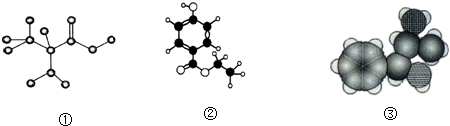
| A. | 图①是球棍模型,其化学式为:C3H7O2N,是一种蛋白质 | |
| B. | 图②是比例模型,其化学式为:C9H13NO,该物质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 图③是球棍模型,其化学式为:C9H10O3,1 mol该物质能消耗3mol氢氧化钠 | |
| D. | 图③是比例模型,其化学式为:C9H13ON,能够发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com