
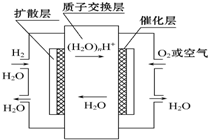
| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 导电离子为质子,且在电池内部由正极定向移向负极 | |
| D. | 总反应式为2H2+O2=2H2O |
分析 氢氧燃料电池中,通入燃料氢气的电极是负极,发生氧化反应、通入氧化剂氧气的电极是正极发生还原反应,阳离子移向正极,阴离子移向负极,总反应即燃料燃烧反应,据此分析解答.
解答 解:A.燃料电池中,负极上通入燃料、正极上通入氧化剂,所以正极通入氧气,发生还原反应,故A错误;
B.燃料电池中,负极上通入燃料,所以负极通入H2,发生氧化反应,故B错误;
C.导电离子为质子.质子带正电荷,应由负极移向正极,故C错误;
D.总反应即燃料燃烧反应即2H2+O2=2H2O,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高考高频点,明确原电池原理是解本题关键,所有燃料电池中都是负极上通入燃料、正极上通入氧化剂,会根据溶液酸碱性书写电极反应式.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| X | |||
| Z | Y | W |
| A. | X、Y、W的氧化物都属于酸性氧化物 | |
| B. | 工业上采用电解Z的氯化物制备Z单质 | |
| C. | W的单质易溶于XW2 | |
| D. | 1molX或Y的最高价氧化物分子中都含有2mol双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
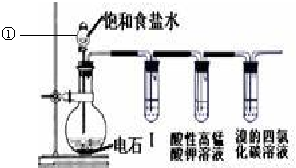
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (ml) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
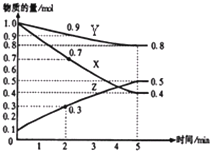
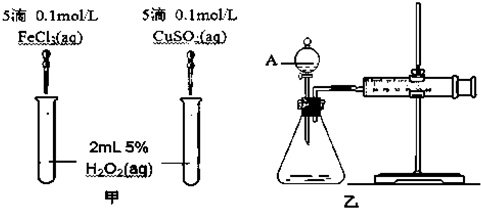
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
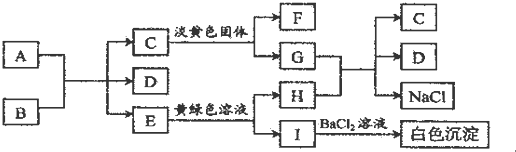
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | ⅣA | ⅤA | ⅥA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
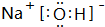 或
或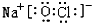 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②④⑥ | C. | ③⑤⑥⑦ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com