
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空)。
(2)DA2分子的VSEPR模型是___________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。
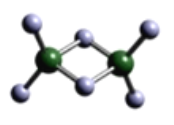
②[C(OH)4]-中存在的化学键有________。
(4)B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
(5)D与E形成化合物晶体的晶胞如下图所示:
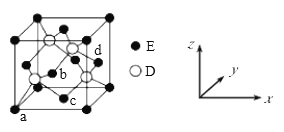
①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
【答案】Mg平面三角形分子sp3极性共价键、配位键Al3+比Mg2+电荷多,半径小4(1,![]() ,
,![]() )
)![]() ×1010
×1010
【解析】
A、D同主族且有两种常见化合物DA2和DA3,A为O元素,D为S元素;工业上电解熔融C2A3制取单质C,C为Al元素;B的原子序数在A与C之间,B最外层只有2个电子,其余各层全充满,B为Mg元素;E最外层只有2个电子,其余各层全充满,E位于元素周期表的ds区,E为Zn元素。
(1)第一电离能:Mg>Al。
(2)用价层电子对互斥理论判断DA2的VSEPR模型。
(3)①Al2Cl6加热时易升华,Al2Cl6属于分子晶体,Al形成4个σ键,Al上没有孤电子对,Al为sp3杂化。
②[Al(OH)4]-中含配位键和极性共价键。
(4)Al3+所带电荷数大于Mg2+,Al3+的半径小于Mg2+,AlF3的晶格能大于MgF2。
(5)①用“均摊法”和晶胞结构确定E的配位数。
②根据坐标系和晶胞中位置分析。
③用“均摊法”确定晶胞中所含D、E的个数,确定晶体的化学式,由密度计算1mol晶体的体积,继而计算晶胞的体积和晶胞的边长,2个D之间的距离是面对角线的一半。
A、D同主族且有两种常见化合物DA2和DA3,A为O元素,D为S元素;工业上电解熔融C2A3制取单质C,C为Al元素;B的原子序数在A与C之间,B最外层只有2个电子,其余各层全充满,B为Mg元素;E最外层只有2个电子,其余各层全充满,E位于元素周期表的ds区,E为Zn元素。
(1)B、C分别是Mg、Al,Al的价电子排布式为3s23p1,Mg的价电子排布式为3s2,Mg的3s全充满较稳定,第一电离能:Mg>Al,第一电离能较大的是Mg。答案为:Mg
(2)DA2为SO2,SO2中中心原子S上的孤电子对数为![]() ×(6-2×2)=1,S的σ键电子对数为2,S的价层电子对数为1+2=3,SO2的VSEPR模型是平面三角形。答案为:平面三角形
×(6-2×2)=1,S的σ键电子对数为2,S的价层电子对数为1+2=3,SO2的VSEPR模型是平面三角形。答案为:平面三角形
(3)①Al2Cl6加热时易升华,Al2Cl6属于分子晶体。根据Al2Cl6的结构示意图,Al形成4个σ键,Al上没有孤电子对,Al为sp3杂化。答案为:分子 sp3
②[Al(OH)4]-中Al3+与OH-之间为配位键,OH-内O与H之间为极性共价键,[Al(OH)4]-中含配位键和极性共价键。答案为:极性共价键、配位键
(4)Al3+所带电荷数大于Mg2+,Al3+的半径小于Mg2+,AlF3的晶格能大于MgF2。答案为:Al3+比Mg2+电荷多,半径小
(5)①用“均摊法”,晶胞中含S(D):4个,含Zn(E):8×![]() +6×
+6×![]() =4个,D与E的个数比为1:1,D的配位数为4,则E的配位数为4。答案为:4
=4个,D与E的个数比为1:1,D的配位数为4,则E的配位数为4。答案为:4
②原子的坐标参数:a(0,0,0);b(1/2,0,1/2);c(1/2,1/2,0),b位于前面的面心,c位于下底面的面心,d位于右侧面的面心,d原子的坐标参数为(1,![]() ,
,![]() )。答案为:(1,
)。答案为:(1,![]() ,
,![]() )
)
③用“均摊法”,晶胞中含S(D):4个,含Zn(E):8×![]() +6×
+6×![]() =4个,D与E的个数比为1:1,晶体的化学式为ZnS,1molZnS的质量为97g,1mol晶体的体积为
=4个,D与E的个数比为1:1,晶体的化学式为ZnS,1molZnS的质量为97g,1mol晶体的体积为![]() cm3;1个晶胞的体积为
cm3;1个晶胞的体积为![]() cm3,晶胞的边长为
cm3,晶胞的边长为![]() cm,两个D原子之间的距离为面对角线的一半,两个D原子之间的距离为
cm,两个D原子之间的距离为面对角线的一半,两个D原子之间的距离为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm。答案为:
×1010pm。答案为:![]() ×
×![]() ×1010
×1010


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是
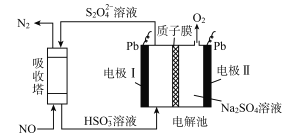
A. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D. 每处理1 mol NO电解池质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图装置(启普发生器)制取氢气,欲使得到氢气的速率加快,下列措施可行的是
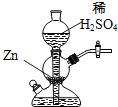
A. 将稀硫酸改为浓硫酸
B. 向稀硫酸中加入少量![]() 固体
固体
C. 向稀硫酸中加入![]() 溶液
溶液
D. 给装置中发生反应的部分加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2C12)和氯化亚砜(SOC12)在空气中遇水蒸气发生剧烈反应,并产生大量白雾。硫酰氯(SO2C12)常用作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。合成的反应式为: SO2(g) + Cl2(g)![]() SO2Cl2(l) △H=-197.3 kJ·mol-1
SO2Cl2(l) △H=-197.3 kJ·mol-1
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2C12 | -54.1 | 69.1 | 易分解:SO2C12 |
合成SO2C12的装置如下图所示(夹持仪器已省略),请回答有关问题:
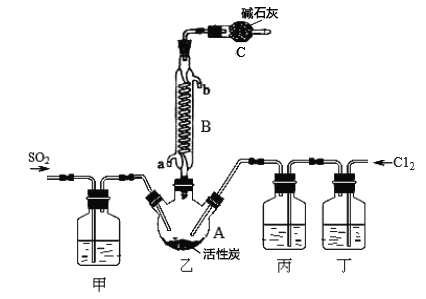
(1)写出浓盐酸和氯酸钾反应制取Cl2的离子方程式_________________。
(2)丁中盛放的是_____________。
(3)反应结束后,将乙中混合物分离开的实验操作名称是 _______________。
(4)图中装置C的作用是__________________。
(5)氯化亚砜(SOCl2)与水反应的化学方程式为_____,蒸干A1C13溶液不能得到无水AlCl3,用SOC12与AlCl3 6H2O的混合加热,可得到无水A1C13,试解释原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
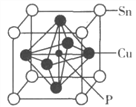
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. CH2=CHCOOH、CH3COOCH=CH2均可作为合成聚合物的单体
B. C6Hn分子中的六个碳原子在同一直线上,则n可能等于2
C. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同
D.  与
与 都是酚且互为同系物
都是酚且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列下列关于F、Cl、Br、I的比较,不正确的是( )
A.单质的氧化性随核电荷数的增加而减弱
B.单质的颜色随核电荷数的增加而加深
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.它们的原子核外电子层数随核电荷数的增加而增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com