氨气在化肥、致冷剂、有机合成工业中都有广泛应用.
(1)实验室制取氨气的化学方程式为
Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O
Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O
.
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生反应也可生成氨气.
已知:①2N
2(g)+6H
2O(l)═4NH
3(g)+3O
2(g)△H
1=2akJ?mol
-1②N
2(g)+3H
2(g)═2NH
3(g)△H
2=-92.4kJ?mol
-1③2H
2(g)+O
2(g)=2H
2O(l)△H
3=-571.6kJ?mol
-1则a=
765
765
.
(3)N
2+3H
22NH
3在密闭容器中反应一段时间后,达到平衡状态.关于此平衡状态的说法正确的是
②④
②④
.
①该反应的K=c(N
2)?c
3(H
2)/c
2(NH
3) ②2υ
正(H
2)=3υ
逆(NH
3) ③改变条件,N
2、H
2、NH
3的浓度可能会变化,K值也会随之变化 ④每有3molH-H键断裂,同时一定有6molN-H键断裂
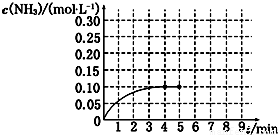
(4)在一容积为2L的密闭容器中,加入0.2mol N
2和0.6mol H
2,在一定条件下发生如下反应:N
2(g)+3H
2(g)═2NH
3(g)△H<0.反应中NH
3的物质的量浓度的变化情况如图所示.
结合如图计算从反应开始到平衡时,用NH
3表示的平均反应速率υ(NH
3)=
0.025mol/(L?min)
0.025mol/(L?min)
.反应到平衡时N
2的转化率为
50%
50%
.

 氨气在化肥、致冷剂、有机合成工业中都有广泛应用.
氨气在化肥、致冷剂、有机合成工业中都有广泛应用.

 53随堂测系列答案
53随堂测系列答案