
分析 (1)氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质;根据三行式计算上述体系的平衡常数;
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向正向移动,溶液的PH值将增大;②通入适量氯气,氯气的浓度不变平衡不移动;
(3)如果增大氯气的压强,平衡将向气体体积缩小的方向移动,氯气在水中的溶解度将增大,参与反应的氯气的极其微弱.
解答 解:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO (水视为纯液体)
C起 0.09 0 0 0
C变 0.09×$\frac{1}{3}$ 0.03 0.03 0.03
C平 0.06 0.03 0.03 0.03
K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$=$\frac{0.03×0.03×0.03}{0.06}$=0.00045,故答案为:Cl2+H2O?H++Cl-+HClO;0.00045;
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向正向移动,溶液的PH值将增大;②通入适量氯气,氯气的浓度不变平衡不移动,故答案为:正反应方向;增大;不移动;
(3)如果增大氯气的压强,平衡将向气体体积缩小的方向移动,氯气在水中的溶解度将增大,参与反应的氯气的极其微弱,故答案为:右;增大;小于.
点评 本题考查了氯气性质,化学平衡的影响因素影响,平衡计算应用,Cl2溶于水的离子反应方程式;浓度对反应平衡的移动影响;压强对平衡移动的影响判断是解题关键.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
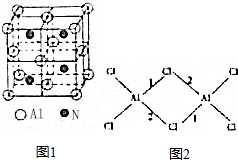
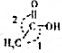 ,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).
,CH3COOH分子中σ键与π键个数之比7:1,分子中键角1<键角2(填“>”、“=”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
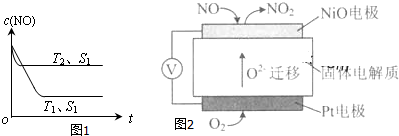
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
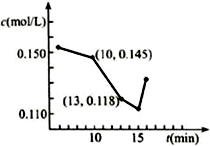
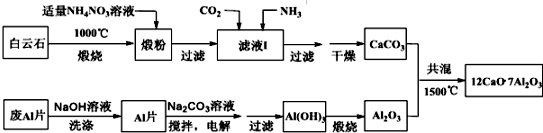
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com