
2013年诺贝尔化学奖授予三位美国科学家,以表彰他们在开发多尺度复杂化学系统模型方面所做的贡献。可以用量子化学计算小区间内(如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有由铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3以外,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有 (不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH3-呈三角锥形
c.NO+电子式为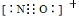

d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极也可人工合成的二价钒(V)固氮酶(结构如下图)。
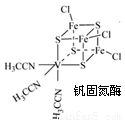
①V2+基态时核外电子排布式为 。
②钒固氮酶钒的配位原子有 (写元素符号)。
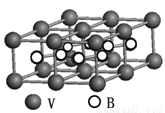
③熔融空气电池钒硼晶体晶胞结构如下图所示,该晶胞中含有钒原子数目为 。
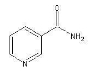
(3)烟酰胺(结构式如图)可用于合成光合辅酶NADPH ,烟酰胺分子中氮原子的杂化轨道类型有 ,1mol该分子中含σ键数目为 。
(1)abc(2分)
(2)①1s22s22p63s23p63d3或[Ar]3d3 (2分)。
②S、N (2分,漏写得1分) ③4(2分)。
(3)sp2、sp3 (2分,漏写得1分,错写该空为零分);15mol(或15×6.02×1023)(2分)。
【解析】
试题分析:(1)a、C2H2为直线型,C2H4为平面结构,均对称为非极性分子,正确;b、此离子中碳原子为sp3杂化,为三角锥形,正确;c、NO+与氮气为等电子体,正确;d、前者含有分子间氢键溶沸点高,错误;(2)与钒原子相连有三个硫原子和三个氮原子;
晶胞中顶点8×1/8=1,棱8×1/4=2,面心2×1/2=1,共4个;(3)环上氮原子形成单键和双键为sp2杂化,氨基中氮原子形成单键,为sp3杂化;σ键环上有6个,还有4个碳氢键,共有15个。
考点:考查物质结构与性质有关问题。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源:2013-2014学年河北省唐山市高三4月第二次模拟理综化学试卷(解析版) 题型:选择题
海水是巨大的资源宝库,下列说法正确的是
A.碘元素又称“海洋元素”
B.镁是海水中含量最多的金属元素
C.从海水中提取食盐和碘的过程都是物理变化
D.氯碱工业和纯碱工业的原料都有食盐
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列说法中用离子方程式表达正确的是
A.用惰性电极电解氯化钠溶液:2Cl-+2H+ H2↑+Cl2↑
H2↑+Cl2↑
B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3 ↓+CO32-
C.Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
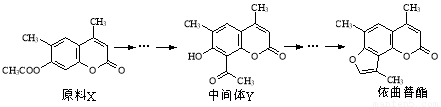
下列说法正确的是
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去反应
D.1 mol依曲替酯只能与1 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用均正确的是
A.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
B.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥
C.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
D.油脂在碱性条件下易水解,可用于制作肥皂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:填空题
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
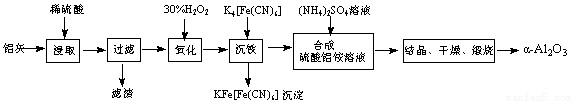
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 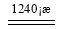 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
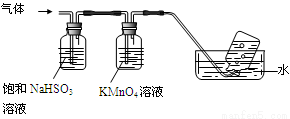
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是
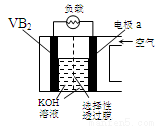
A.电极a为电池负极
B.图中选择性透过膜只能让阳离子选择性透过
C.电子由VB2极经KOH溶液流向a电极
D.VB2极发生的电极反应为:
2VB2 + 22OH?- 22e?→V2O5 + 2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是(相对原子质量:D-2 O-16 Cu-64)
A.18 g的D216O中含有的中子数为9 NA
B.物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.33.6 L NO2溶于足量的水得到的溶液中含有的NO3-数为NA
D.32 g铜发生氧化还原反应,一定失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:填空题
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
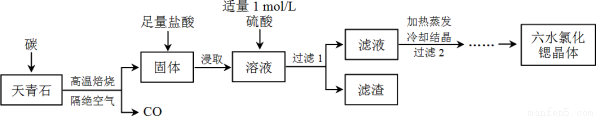
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com