
【题目】已知水的电离平衡曲线如图示,试回答下列问题:
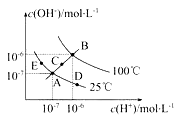
(1)图中五点Kw间的关系是 。
(2)若从A点到D点,可采用的措施是 。
A.升温 B.加入少量的盐酸 C.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
(4)B对应温度下,将pH=11的苛性钠溶液V1 L与0.05mol/L的稀硫酸V2L 混合(设混合后溶液的体积等于原两溶液体积之和),所得混合溶液的pH=2,则 V1∶V2=________________。
(5)常温下,将V mL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反应。请回答下列问题(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为___________。
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=______ ___mol·L-1(填数据)
(6)在0.10 mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
【答案】
(1)E=A=D<C<B;
(2)c;(3)10:1
(4)9:11
(5)①<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);②0.033或1/30
(6)2.2×10–8
【解析】
试题分析:(1)水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,故答案为:B>C>A=D=E;
(2)在A点时,c(H+)=c(OH-),溶液显中性,而到D点c(H+)变大,c(OH-)变小,溶液显酸性,即由A点到D点,溶液由中性变为酸性,但Kw不变。a、升高温度,Kw变大,故a错误;b、加入盐酸,则溶液显酸性,但是水的电离受到抑制,水电离出的c(H+)减小,故b错误;c、加入氯化铵,水解显酸性,且Kw不变,故c正确;故答案为:c;
(3)E对应的温度下,Kw=10-14,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则酸溶液中的n(H+)等于碱溶液中的n(OH-),故有:10-5mol/L×V碱=10-4mol/L×V酸,解得:![]() =
=![]() ,故答案为:10:1;
,故答案为:10:1;
(4)该温度下水的离子积为Kw=1×10-12,将pH=11的苛性钠中氢氧根离子浓度为:c(OH-) = ![]() mol/L = 0.1mol/L,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),整理可得:V1:V2=9:11,故答案为:9:11;
mol/L = 0.1mol/L,0.05mol/L的稀硫酸溶液中氢离子浓度为1mol/L,pH=2的溶液中氢离子浓度为0.01mol/L,则混合液中满足:0.1mol/L×V2-0.1mol/L×V1=0.01mol/L×(V1+V2),整理可得:V1:V2=9:11,故答案为:9:11;
(5)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000molL-1氢氧化钠溶液逐滴加入到20.00mL、0.1000molL-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),溶液中的溶质为乙酸钠溶液,水的电离是微弱的,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)],得到c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-),则c(OH-)-c(H+)-c(CH3COOH) =c(CH3COO-)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO-)+c(CH3COOH) ═![]() =0.033mol/L,故答案为:0.033;
=0.033mol/L,故答案为:0.033;
(6)在0.1molL-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42-)不变,为0.1molL-1,由电荷守恒可知c(H+)为0.2molL-1,故答案为:2.2×10-8。


科目:高中化学 来源: 题型:
【题目】下列过程不涉及化学反应的是
A. 用含NaHCO3的干粉灭火剂灭火
B. 用活性炭口罩防护空气中的粉尘等有害物质
C. 向95%酒精中加生石灰蒸馏来制取无水酒精
D. 含活性炭、细铁、食盐及蛭石等的暖手宝,在被使用时会发热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市环境中的大气污染物主要是
A. CO2、Cl2、N2、酸雨 B. SO2、NO2、CO、可吸入颗粒物
C. NH3、CO2、NO2、雾 D. HCl、SO2、N2、可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B.酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C.燃烧热或中和热是反应热的种类之一
D.吸热反应没有利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列金属的熔沸点:
金属 | Na | Cu | Al | Fe |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点(℃) | 883 | 2595 | 2200 | 3000 |
其中不能形成合金的是
A. Cu与Al B. Fe与Na C. Fe与Cu D . Al与Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为 C> A> B >D >E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出以下元素的名称 A_________ C_________
(2)B元素在元素周期表中的位置是_______________;D2分子的结构式是______________。
(3)实验室制取D的氢化物的化学反应方程式为_________________________。
(4)用电子式表示化合物A2B的形成过程______________________。
(5)M、N均由A、B、C、E四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)在下列化合物中:H2O 、Na2O 、I2 、NaCl、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)只由非金属组成的离子化合物是________________,
(2)含有极性共价键的离子化合物是________________,
(3)只含有非极性共价键的是______________________,
(4)既有离子键又有非极性键的化合物是___________________。
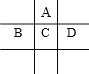
(Ⅱ)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。
请回答下列问题:
(1)写出B元素的原子结构示意图_______________________;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为______________;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是:_______________,最后阶段反应的离子方程式为___________________;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示):___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com