
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |
分析 原子结构的周期表变化(核外电子排布呈周期性变化)引起元素的性质(元素化合价、金属性、非金属性、原子半径等)出现周期性变化,以此来解答.
解答 解:A.由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故A正确;
B.化合价属于元素的性质,元素的化合价的周期性变化是原子的电子排布周期性变化的结果,故B错误;
C.原子核外电子排布的周期性变化决定元素金属性和非金属性的周期性变化,故C错误;
D.元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故D错误.
故选A.
点评 本题考查原子结构与元素周期律的实质,为高频考点,把握结构决定性质、元素的性质有哪些为解答的关键,侧重分析与应用能力的考查,注意周期性的理解,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
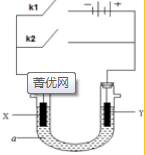 原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题: Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);
Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了“KNO3的氧化性” | |
| B. | 李白有诗云“日照香炉生紫烟”这是描写“碘的升华” | |
| C. | 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,烟起,乃真硝石也”这是利用了“焰色反应” | |
| D. | 我国古代人民常用明矾除去铜器上的铜锈[Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、K+、SO42ˉ、NO3ˉ | B. | Mg2+、NH4+、SO42-、Clˉ | ||
| C. | Na+、K+、SO42ˉ、NO3ˉ | D. | Ba2+、Na+、CO32-、NO3ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C=C | C-C | H-H |
| 键能 (kJ/mol) | 414 | 615 | 347 | 435 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com