
分析 (1)硫酸铜先和氨水反应生成氢氧化铜;
(2)当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物;
(3)析出的蓝色晶体是硫酸四氨合铜晶体;
(4)配离子中存在配位键,配体氨气中存在极性共价键;
(5)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度.
解答 解:(1)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,反应离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
(2)当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,反应离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4 H2O,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4 H2O;
(3)析出的蓝色晶体是硫酸四氨合铜晶体,其化学式为:[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O;
(4)深蓝色溶液中的阳离子是配离子[Cu(NH3)4]2+,铜离子提空轨道,氨气提供孤对电子,从而形成配位键,配体氨气中存在N-H极性共价键,
故答案为:极性共价键和配位键;
(5)向深蓝色透明溶液加入乙醇,由于[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体:Cu(NH3)4SO4•H2O,则加入乙醇的作用是降低了[Cu(NH3)4]SO4•H2O的溶解度,
故答案为:降低了[Cu(NH3)4]SO4•H2O的溶解度.
点评 本题考查了铜及其化合物的性质,主要涉及实验室制取配合物的反应原理、离子方程式书写、配合物的成键情况等知识,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子式为C16H14O4 | |
| B. | 1mol化合物X在一定条件下最多加成6molH2 | |
| C. | 分子中有三种官能团,酸性条件下水解后官能团还是三种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| B. | 沉淀溶解平衡过程是可逆的 | |
| C. | 在平衡状态时v溶解=v结晶=0 | |
| D. | 达到沉淀溶解平衡的溶液一定是饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;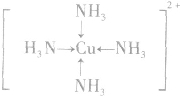 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量的水 | B. | 适当升高温度 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入等体积的浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | CH2═CH-C6H5分子中的所有原子可能共平面 | |
| C. | 乙烷分子中的所有原子可能共平面 | |
| D. | 二氯甲烷分子为正四面体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
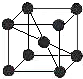 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:| A | B | |
| D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com