
| A. | Fe2O3+3CO═2Fe+3CO2 | B. | Ca(OH)2+CO2═CaCO3↓+H2O | ||
| C. | CuO+H2═Cu+H2O | D. | 2Na+Cl2═2NaCl |
分析 有元素化合价变化的反应为氧化还原反应,单质与化合物反应生成单质和化合物的反应为置换反应,置换反应一定属于氧化还原反应,以此来解答.
解答 解:A.一氧化碳还原氧化铁生成铁和二氧化碳,不属于四种基本反应类型,C、Fe元素的化合价变化,属于氧化还原反应,故A错误;
B.二氧化碳与Ca(OH)2反应生成碳酸钙和水,属于复分解反应,没有元素的化合价变化,不属于氧化还原反应,故B错误;
C.氢气还原氧化铜生成Cu和水,属于置换反应,反应中H、Cu元素的化合价变化,属于氧化还原反应,故C正确;
D.钠在氯气中燃烧生成氯化钠,属于化合反应,Na、Cl元素的化合价变化,属于氧化还原反应,故D错误.
故选C.
点评 本题考查四种基本反应类型和氧化还原反应,明确发生的化学反应及反应的分类即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
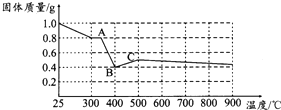 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
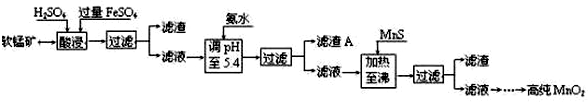
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 铁和稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,78g Na2O2含有的阴离子数为NA | |
| B. | 常温常压下,22.4 L氢气中含氢原子数目为2 NA | |
| C. | 0.5 mol/L的NaCl溶液中,含有Cl-数目为0.5 NA | |
| D. | 1mol Fe在足量氯气中完全反应,失去的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com