
分析 (1)用孔雀石耗用的盐酸与生成的CO2的物质的量比为4:1,计算出化学组成可表示为xCuCO3•yCu(OH)2中x、y的比,再根据x、y为正整数且x≤2,y≤2的限制条件,推断出两物质的化学组成;发生反应:xCuCO3•yCu(OH)2+(2x+2y)HCl═(x+y)CuCl2+xCO2↑+(x+2y)H2O,计算出化学组成可表示为xCuCO3•yCu(OH)2中x、y关系,再根据x、y为正整数且x≤2,y≤2的限制条件解答;
(2)设孔雀石和石青的物质的量分别为amol、bmol,根据方程式表示出生成的二氧化碳、CuO,列方程计算解答.
解答 解:(1)根据孔雀石耗用的盐酸与生成的CO2的物质的量比为4:1,
和化学方程式xCuCO3•yCu(OH)2+2(x+y)HCl→(x+y)CuCl2+xCO2↑+(x+2y)H2O
可知:2(x+y):x=4:1,可得x:y=1:1,
∵x、y为正整数且x≤2,y≤2,
∴孔雀石的化学式可表示为CuCO3•Cu(OH)2;
而石青发生反应:xCuCO3•yCu(OH)2+(2x+2y)HCl═(x+y)CuCl2+xCO2↑+(x+2y)H2O,石青耗用的盐酸与生成的CO2的物质的量比为3:1,则(2x+2y):x=3:1,解得x=2y,
∵x、y为正整数且x≤2,y≤2,故x=2、y=1,
∴石青的化学式可表示为2CuCO3•Cu(OH)2,
故答案为:CuCO3•Cu(OH)2;2CuCO3•Cu(OH)2;
(2)设孔雀石和石青的物质的量分别为amol、bmol,则:
CuCO3•Cu(OH)2+4HCl═2CuCl2+CO2↑+3H2O
1 1
amol amol
2CuCO3•Cu(OH)2+6HCl═3CuCl2+2CO2↑+4H2O
1 2
bmol 2bmol
CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O
1mol 160g
amol 160ag
2CuCO3•Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$3CuO+2CO2↑+H2O
1mol 240
bmol 240bg
则a+2b=$\frac{6.6g}{44g/mol}$,160ag+240bg=20g,
解之得a=0.05,b=0.05
该混合物中孔雀石和石青的物质的量之比=0.05mol:0.05mol=1:1,
答:孔雀石和石青的物质的量之比为1:1.
点评 本题考查化学式的推断、化学反应方程式的计算,注意根据方程式进行计算解答,题目难度中等,侧重于考查学生的分析能力和计算能力.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 |  |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 | 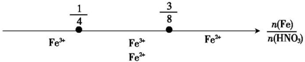 |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | O.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )| A. | 右边CO与CO2分子数之比为1:3 | |
| B. | 右侧气体密度是相同条件下氢气密度的18倍 | |
| C. | 右侧CO的质量为1.75g | |
| D. | 若隔板处于距离右端$\frac{1}{6}$处,其他条件不变,则前后两次压强之比为25:24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min n/mol | 0min | 2min | 4min | 6min | 8min |
| n(X) | 0.2 | 0.15 | 0.1 | 0.1 | 0.05 |
| n(Y) | 0.6 | 0.45 | 0.3 | 0.3 | 0.5 |
| n(Z) | 0 | 0.1 | 0.2 | 0.2 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA | |
| D. | 1 mol甲基(-CH3)中含有电子的数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com