
下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D 中选择:
A.M>N B.M<N C. M="N" D. 无法比较
(1)相同温度下,1L 1mol/L 的NH4Cl溶液和2 L 0.5mol·L-1NH4Cl溶液,两溶液中NH4+的个数: ;
(2)相同温度下,pH值为12的烧碱溶液和CH3COONa溶液,两溶液中水的电离程度: ;
(3)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(4)将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
(1)A (2)B (3)B (4)B
解析试题分析:(1)氯化铵中,铵根离子水解,铵根离子浓度越大水解程度越小,即相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数大于2L 0.5mol?L-1NH4Cl溶液中NH4+的个数,故答案为:A;(2)pH值为12的烧碱溶液中水电离出的氢离子浓度为10-12mol/L,pH值为12的CH3COONa溶液中水电离出的氢离子浓度为10-2mool/L,所以相同温度下,pH值为12的烧碱溶液中水的电离度小于pH值为12的CH3COONa溶液中水的电离度,故答案为:B;(3)碳酸钠溶液中,碳酸根的水解程度随着温度的升高而增大,及升高温度以黄埔,碳酸氢根的浓度增大,故答案为:B;(4)醋酸是弱酸,稀释促进电离,盐酸是强酸,稀释过程浓度减小,所以将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值是醋酸的小于盐酸的,故答案为:B;
考点:影响盐类水解程度的主要因素;有关ph的计算


科目:高中化学 来源: 题型:填空题
在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是_______________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是② ③(填“>”“=”或“<”)。
(3)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:
0.10mol/L醋酸溶液、pH=3的盐酸、pH=3的醋酸、NaAC晶体、NaCL晶体、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.10mol/L的醋酸溶液pH=4,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”)
(2)乙取出10ml0.10mol/L的醋酸溶液,用pH试纸测出其pH=a,然后用蒸馏稀释到1000mL,在用pH试纸测定其pH=b,要确定醋酸是弱电解质,则a、b应该满足的关系是 (用“等式”或“不等式”表示)
(3)丙将pH=3醋酸和盐酸,各取10ml,用蒸馏水稀释到原来的100倍,然后用pH试纸测定该溶液的pH,醋酸的变化小,则认定醋酸是弱电解质,你认为这一方法正确吗?
(填“正确”或“不正确”)
(4)丁将pH=3醋酸和盐酸,分别加入相应的钠盐固体,醋酸的PH变化大,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
(5)戊取pH=3的盐酸和醋酸,分别稀释到原来的100倍,然后加入完全一样的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?(填“正确”或“不正确”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
结合下表回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA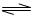 H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。
H++A―,则该弱酸的电离平衡常数的表达式为K=__________。下表是几种常见弱酸的电离平衡常数(25℃)。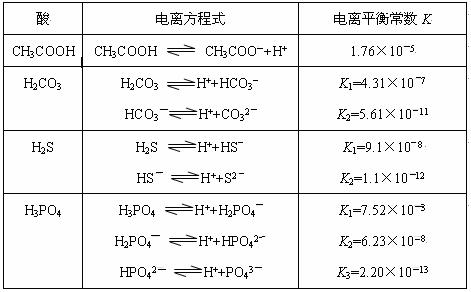
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值______(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_____________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10―5:10―10,产生此规律的原因是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下。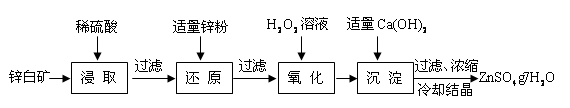
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。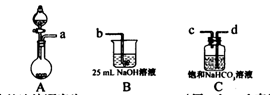
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下: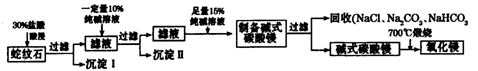
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下: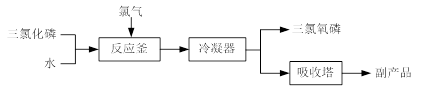
⑴氯化水解法生产三氯氧磷的化学方程式为 。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是 。
②下图是不同条件对磷的沉淀回收率的影响图像。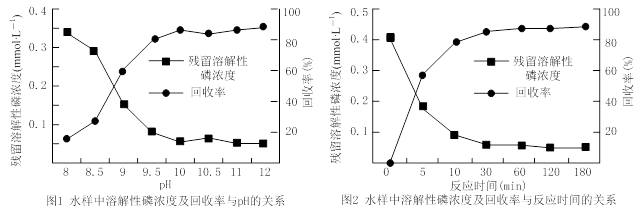
处理该厂废水最合适的工艺条件为 (选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)= mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com