
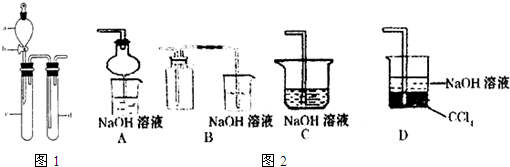


科目:高中化学 来源: 题型:
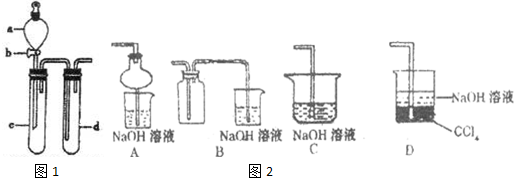
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.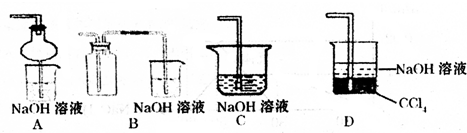
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:填空题
SO2是一种重要的化工原料,也是一种环境污染物。
(1)SO2可用于工业制Br2过程中吸收潮湿空气中的Br2,反应的离子方程式是 。
(2)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol•L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
①此时溶液中c(SO32-)的浓度是0.2 mol•L-1,则溶液中c(HSO3-)是_________mol•L-1,由此说明NaHSO3溶液显 性,用化学平衡原理解释: 。
②向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com