
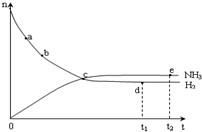
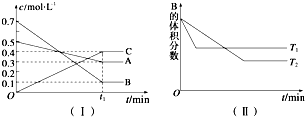
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d正反应速率和点 e的逆反应速率一样 |
分析 A.物质的物质的量越大,其反应速率越大;
B.正逆反应速率相等时,可逆反应达到平衡状态,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变;
C.平衡状态时各物质的物质的量不变;
D.达到平衡状态时,各物质的反应速率之比等于其计量数之比.
解答 解:A.物质的物质的量越大,其反应速率越大,a的物质的量大于b点,所以点a的正反应速率比点b的大,故A正确;
B.c处氨气和氢气的物质的量相等,但随着时间的变化,二者的物质的量发生变化,说明c点没有达到平衡状态,故B错误;
C.平衡状态时各物质的物质的量不变,de处氨气、氢气的物质的量不变,说明达到平衡状态,则点d(t1时刻) 和点e(t2时刻)处n(N2)一样,故C错误;
D.达到平衡状态时,各物质的反应速率之比等于其计量数之比,de处为平衡状态,氢气正反应速率与氨气逆反应速率之比为3:2,故D错误;
故选A.
点评 本题考查图象分析,侧重考查学生分析判断能力,涉及平衡状态判断、物质的量与反应速率的关系等知识点,易错选项是D,用不同物质表示同一可逆反应的反应速率其反应速率可能不同,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C30H50 | B. | C30H52 | C. | C30H56 | D. | C30H60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2一甲基一2一丁烯 | B. | 3,3一二甲基一2一丁醇 | ||
| C. | 4一甲基苯酚 | D. | 2,3,4一三甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴苯中的溴(KI溶液) | B. | 溴乙烷中的乙醇(水) | ||
| C. | 苯中的苯酚(溴水) | D. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 结构简式 | 沸点/℃ | 结构简式 | 沸点/℃ |
| CH3CH3 | -88.6 | CH2=CH2 | -103.7 |
| CH3CH2CH3 | -42.2 | CH2=CHCH3 | -47.4 |
| CH3CH2CH2CH3 | -0.5 | CH3CH2CH=CH2 | -6.3 |
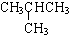 | -11.7 | 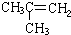 | -6.9 |
| CH3CH2CH2CH2CH3 | 36.1 | CH3CH2CH2CH=CH2 | 30 |
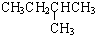 | 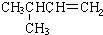 | 20.1 |
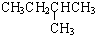 在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).
在1.013×105Pa、25℃时的状态是气态(填气态、液态或固态).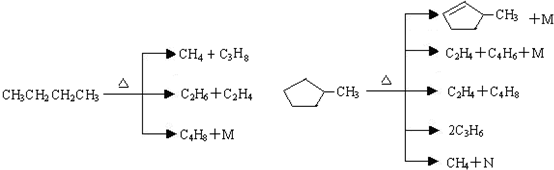
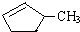 的说法正确的是A.
的说法正确的是A.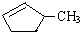 和
和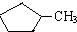
 和
和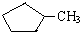 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同 可与水以任意比互溶
可与水以任意比互溶查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
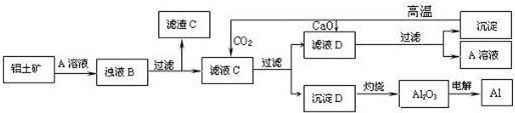
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com