
| A. | Fe═Fe2++2e- | B. | Cu2++2e-═Cu | C. | Fe═Fe3++3e- | D. | Zn═Zn2++2e- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 蒸发 | B. | 蒸馏 | C. | 过滤 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的NaCl溶液是指由1mol NaCl和1000mL水配制成的溶液 | |
| B. | 从1L 0.5mol•L-1的NaCl溶液中取出100mL,剩余溶液物质的量浓度为0.45mol•L-1 | |
| C. | 标准状况下,18克H2O所含的氧原子数目为NA | |
| D. | 0℃时,2mol Cl2的体积不可能为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
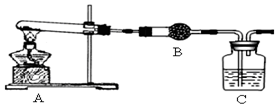
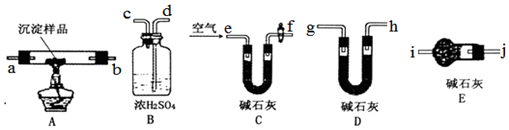
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
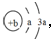 ,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题:
,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题: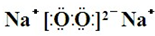 ,所含有的化学键类型为离子键和共价键.
,所含有的化学键类型为离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ NO3- I-SO42- | B. | MnO4- K+NO3-Na+ | ||
| C. | K+Al3+Cl-SO42- | D. | Mg2+SO32-Br-Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热的测定实验时,眼睛要注视温度计的刻度变化 | |
| B. | 萃取时,将混合物充分振荡后,需静置,待液体分层明显后才能分液 | |
| C. | 中和滴定实验时,为了使滴定终点的现象更加明显,可以滴加较多的指示剂 | |
| D. | 蒸馏时,温度计的读数刚达到某物质的沸点,不能立即收集馏出物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com