
| 选项 | 实验操作 | 现象 | 结论 |
| A | 测定常温时的饱和HCOONa溶液、CH3COONa溶液的pH | HCOONa的pH<CH3COONa的pH | 弱酸的酸性:HCOOH>CH3COOH |
| B | 向5ml 2mol•L-1NaOH溶液中加入1ml 1mol•L-1CuSO4溶液,振荡后加入0.5ml有机物X,加热 | 未出现砖红色沉淀 | 说明X中不含有醛基 |
| C | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙红色 | 氧化性:Cl2>Br2 |
| D | NaAlO2溶液与NaHCO3溶液混合 | 有白色絮状沉淀生成 | 二者水解相互促进生成氧化铝沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者溶解度不同,饱和时浓度不同,无法比较水解程度大小;
B.含有醛基的有机物能够与新制氢氧化铜反应生成砖红色的氧化亚铜沉淀;
C.有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂;
D.碳酸氢根离子的酸性大于氢氧化铝,二者发生的是强酸制取弱酸的反应,不是双水解反应.
解答 解:A.饱和HCOONa溶液和CH3COONa溶液的浓度不相同,无法比较二者的水解程度,则无法比较HCOOH、CH3COOH的酸性强弱,故A错误;
B.向5ml 2mol•L-1 NaOH溶液中加入1ml 1mol•L-1 CuSO4溶液可以制备氢氧化铜浊液,振荡后加入0.5ml有机物X,加热,该操作方法合理,若未出现砖红色沉淀,说明说明X中不含有醛基,故B正确;
C.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂,说明氧化性:Cl2<KBrO3,无法得出氧化性Cl2>Br2,故C错误;
D.由于碳酸氢根离子的酸性大于氢氧化铝,NaAlO2溶液与NaHCO3溶液混合后生成氢氧化铝沉淀和碳酸钠,没有发生双水解反应,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度不大,涉及氧化还原反应、盐的水解原理、醛基检验等知识,明确常见元素及其化合物性质即可解答,试题培养了学生的分析能力及灵活应用能力.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
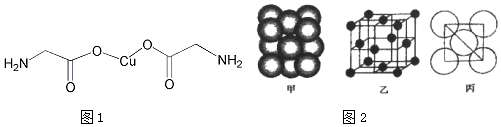
 A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )
A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍.A、B、C三种元素的单质在适当条件下可发生如图所示的变化.下列说法不正确的是( )| A. | 甲、乙、丙三种物质的水溶液均显碱性 | |
| B. | 单质A、C均存在同素异形体 | |
| C. | 甲、乙可能都其有漂白性 | |
| D. | 丙的水溶液在空气中长期放置,溶液可能会变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:
世界上最早现并使用锌的是中国,明朝末年《天工开物》一书中有世界上最早的关于炼锌技术的记载.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 脱氧过程是吸热反应,可降低温度,延长食品保质期 | |
| B. | 脱氧过程中炭作原电池正极,电极反应为4H++O2+4e-═2H2O | |
| C. | 含有0.56g铁粉的脱氧剂,理论上最多能吸收氧气168mL (标准状况) | |
| D. | 该过程实现了电能到化学能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=4的氯化铵溶液中:c(H+)=c(NH3•H2O )=1×10-4mol•L-1 | |
| B. | pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<② | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液以体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
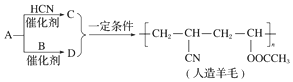
| A. | A生成D的反应属于取代反应 | B. | A生成C的反应属于加成反应 | ||
| C. | 合成人造羊毛的反应属于加聚反应 | D. | 烃A的结构简式为CH≡CH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com