
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 溴水 | 过滤 |
B | 甲烷(甲醛) | 银氨溶液 | 萃取 |
C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(10分)常温下,现有A、B、C、D四种电解质分别完全溶于水,所得四种溶液中含H+、Ba2+、Al3+、Na+、HCO3-、Cl-、OH-、SO42-八种离子(不考虑水解)。为了检验这四种物质,进行如下实验:
①取少量A的溶液分别与另三种物质反应,依次观察到:白色沉淀和气体、气体、白色沉淀。
②经测定,A和D的溶液显碱性,B和C的溶液pH<7。B与D的溶液反应产生两种沉淀,当D的量增大时,其中一种沉淀不断溶解,最终还存在一种沉淀。
③C与D的溶液反应,无明显现象。经测定,该反应的产物总能量小于反应物总能量。
根据上述实验事实,请回答下列问题:
(1)C的名称是________,D的化学式_________。
(2)用离子方程式表示A的溶液显碱性的原因:_________________。
(3)A与B在溶液中反应的离子方程式为________________。
(4)等物质的量浓度、等体积的B和D的溶液混合,写出反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精。已知D是一种常见的烃,在标准状况下的密度为1.25 g·L-1,其产量可以用来衡量一个国家石油化工发展水平。E是生活中常见的一种有机物。各物质间转化关系如下:
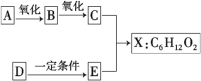
请回答下列问题:
(1)A的名称是 。
(2)B中所含的官能团是 。
(3)C+E→X的化学反应类型是 反应。
(4)写出任意两种与A具有相同官能团的A的同分异构体的结构简式(不含A): 。
(5)X与氢氧化钠溶液反应的化学方程式是: 。
(6)以D为原料生产一种常见塑料的化学方程式是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应的通式可表示为:
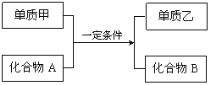
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为植物光合作用的产物,则该反应的化学方程式为 。
(2)若单质甲和化合物B均具有磁性,则该反应的化学方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常用作耐高温材料,则该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃ ),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
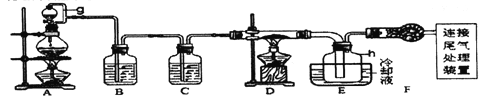
相关信息:① 四氯化硅遇水极易水解;② SIC14沸点为57.7℃ ,熔点为-70.0℃ 。请回答:
(1)写出装置A 中发生反应的离子方程式_______________。
(2)装置C 中的试剂是___________;装置F的作用是_______________;
装置E 中的h 瓶需要冷却的理由是_______________。
(3)装置E 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
① 反应的离子方程式:_______________。② 滴定前是否要滴加指示剂?_______________。(填“是”或“否”) ,请说明理由_______________。
③ 滴定前检验Fe3+ 是否完全还原的实验操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
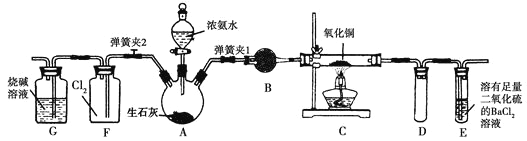
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先 ,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是 。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式: 。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是
(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式: ,迅速产生倒吸的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。(9分)
(1)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。(2分)
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。(2分)
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是_____________________________________(用离子方程式说明)。(5分)
II、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。(6分)
(1)根据题意,可判断出X是________(1分)(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能_______(1分)(填“失去”或“得到”)_____mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com