
 “84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.
“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题. ;升高温度,PH增大,氢氧根离子的浓度增大,次氯酸的浓度增大,次氯酸根离子的浓度减小,所以K增大,
;升高温度,PH增大,氢氧根离子的浓度增大,次氯酸的浓度增大,次氯酸根离子的浓度减小,所以K增大, ;增大;
;增大; 2HCl+O2↑,降低次氯酸的浓度,所以消毒效果降低,
2HCl+O2↑,降低次氯酸的浓度,所以消毒效果降低, 2HCl+O2↑;
2HCl+O2↑; ;根据温度对水解平衡的影响分析;
;根据温度对水解平衡的影响分析;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 (2010?漳州二模)“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.
(2010?漳州二模)“84”消毒液是一种以次氯酸钠(NaClO)为主的高效消毒剂和漂白剂,被广泛用于医院、宾馆、家庭等的卫生消毒.回答有关问题.| c(HClO)?c(OH-) |
| c(ClO-) |
| c(HClO)?c(OH-) |
| c(ClO-) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:漳州二模 题型:填空题
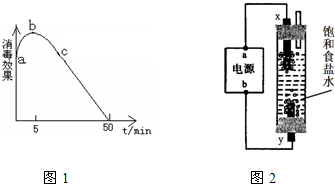
查看答案和解析>>
科目:高中化学 来源:2010年福建省漳州市高考化学二模试卷(解析版) 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com