
【题目】下列说法正确的是( )
A. c(H+)>c(OH-)的溶液一定显酸性
B. 常温下,pH=6的溶液一定是酸溶液
C. 电解稀硫酸或氢氧化钠溶液的产物不同
D. 将纯水加热,其KW增大而pH不变
科目:高中化学 来源: 题型:
【题目】下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
A. CH3CH2CH2CH3 B. CH3CH(CH3)2
C. CH3C(CH3)3 D. (CH3)2CHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
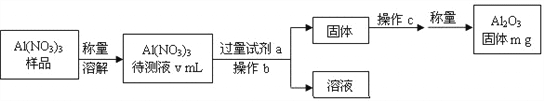
①加入过量试剂a,发生反应的离子方程式为___________________________。
②生成氧化铝的化学反应方程式是_______________________________________。
③Al(NO3)3待测液中,c (Al3+) = ______mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
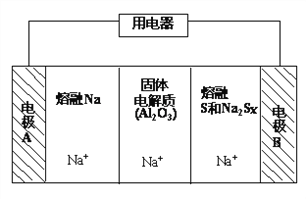
①据下表数据,请你判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
a .100℃以下 b . 300℃~ 350℃ c. 100℃~ 300℃ d. 350℃~ 2050℃
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
②该电池工作时,2Na + xS(3<x<5)=Na2Sx,则电极A上发生的电极反应式是_______。
内电路中Na+的移动方向为_________(填“从A到B”或“从B到A”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂发生Cl2泄漏,以下应对措施中主要是基于Cl2的物理性质考虑的是
A. 向被污染的土壤洒石灰
B. 向远离污染源的高处撤离
C. 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离
D. 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
①N2+3H2![]() 2NH3;②N2+O2
2NH3;②N2+O2![]() 2NO
2NO
根据图中的数据判断下列说法正确的是 ( )
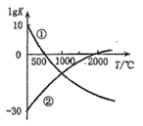
A.只有反应①是放热反应
B.升温,反应①的速率减小反应②的速率增大
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器能用酒精灯火焰直接加热的是
①试管 ②集气瓶 ③蒸犮皿 ④量筒 ⑤烧杯 ⑥燃烧匙
A. ①②⑤ B. ①③⑥ C. ①④⑤⑥ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟是自然界中广泛分布的元素之一。由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异。
Ⅰ.化学家研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:_________________________。

现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
已知KHF2是一种酸式盐,写出阴极上发生的电极反应式________________________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是___________。
Ⅱ.①卤化氢的熔沸点随相对分子质量增加而升高,而HF熔沸点高于HCl的原因是________________________。HF的水溶液是氢氟酸,能用于蚀刻玻璃,其化学反应方程式为:________________________
②已知25 ℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。
某pH=2的氢氟酸溶液,由水电离出的c(H+)=___________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:________________________。
③又已知25 ℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】压强对化学反应速率的影响针对的是( )的反应
A. 一切化学反应 B. 有固体参加或有固体生成的反应
C. 有气体参加或有气体生成的反应 D. 有液体参加或有液体生成的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com