
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
分析 (1)实验①和②探究盐酸浓度对该反应速率的影响,则除了浓度不同以外,其它条件必须完全相同,据此判断①的温度及盐酸浓度;根据实验②和③的数据可知,除温度不同外,其它条件完全相同,则探究的是温度对反应速率的影响;实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响,则除了铝的规格不同以外,其它条件必须完全相同;
(2)对比①和⑤实验可知,除了氯离子和硫酸根离子不同以外,其它条件完全相同,据此判断影响反应速率因素为氯离子和硫酸根离子.
解答 解:(1)根据实验目的可知:实验①和②探究盐酸浓度对该反应速率的影响,则除盐酸浓度的浓度不同外,其它条件必须完全相同,所以①的温度为25℃,酸及浓度为:4.0moL/L盐酸;
根据实验②和③的数据可知,除温度不同外,其它条件完全相同,则实验②和③探究的是反应温度对反应速率的影响;
实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响,则除铝的规格不同以外,其它条件必须完全相同,所以④中温度 25℃、酸及浓度为:2.0moL/L盐酸,
故答案为:
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 2.探究温度对反应速率的影响 | ① | 25℃ | 4.0moL/L盐酸 | |
| ② | ||||
| ③ | ||||
| ④ | 25℃ | 2.0moL/L盐酸 | ||
| ⑤ |
点评 本题考查了影响化学反应速率的因素,题目难度中等,熟练掌握温度、浓度、固体物质的表面积等因素对反应速率的影响为解答关键,注意设计对照试验的方法与要求,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、HClO、HCl、H2O | |
| B. | Cl、Cl-、Cl2、H2O | |
| C. | Cl2、HCl、H2O、Cl-、H+、ClO-和极少量OH- | |
| D. | Cl2、HClO、H2O、Cl-、H+、ClO-和极少量OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
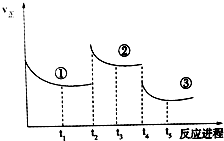 已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )
已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ•mol-1,向密闭容器中加入2mol SO2和1mol O2,一定条件下反应达到平衡,在t2和t4时刻分别只改变一个条件(温度或压强),反应过程中正反应速率如图所示,下列说法正确的是 ( )| A. | t2~t3时间段,平衡向逆反应方向移动 | |
| B. | t4时刻改变的条件是减小压强 | |
| C. | 平衡状态①和②,SO2转化率相同 | |
| D. | 平衡状态①和②,平衡常数K值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
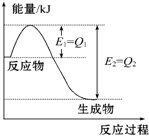 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蓝矾 玻璃 无色的刚玉 | B. | 汽油 液氯 醋酸 | ||
| C. | 石蜡 纯盐酸 王水 | D. | 干冰 铝热剂 铁触媒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、CuSO4、HCl、KNO3 | B. | HCl、KOH、NaCl、Na2SO4 | ||
| C. | Ca(OH)2、Na2CO3、NaCl、HCl | D. | NaNO3、MgCl2、KCl、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用新制氢氧化铜悬浊液可以鉴别有机物中是否含醛基 | |
| B. | 所有的醇都可以发生消去反应生成烯烃 | |
| C. | 羧酸不一定可以与碳酸钠溶液反应 | |
| D. | 苯酚的酸性很弱,不能使指示剂变色,但可以和碳酸氢钠溶液反应放出CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com