
| A. | CH3CH2OH | B. | CH3COOC2H5 | C. | CH3OH | D. | CH3COOCH3 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题
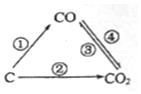 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃时,将amol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3•H2O的电离常数:Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| B. | 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ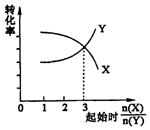 | |
| C. | 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+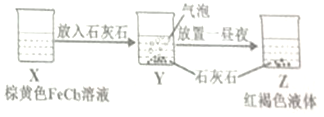 | |
| D. | 将10mL 1 mol•L-1Na2CO3溶液逐滴滴加到10mL1mol•L-1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl-)>c(CO32-)>c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | |
| B. | 卤代烃和醇都可以发生消去 | |
| C. | 乙烯、聚氯乙烯和苯分子均含有碳碳双键 | |
| D. | 卤代烃、酯及酚均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
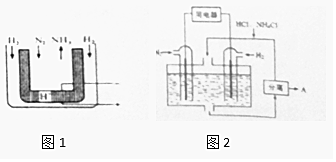 氮及其化合物与人类的生产、生活息息相关.
氮及其化合物与人类的生产、生活息息相关.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com