
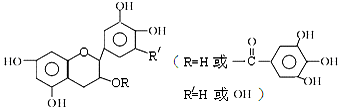
| A. | 儿茶素能与FeCl3溶液发生显色反应 | |
| B. | 1mol儿茶素最多可与10mol NaOH反应 | |
| C. | 常温下,儿茶素不溶于水,也不溶于有机溶剂 | |
| D. | 儿茶素一定不能发生水解反应 |
分析 A.儿茶素含酚-OH;
B.儿茶素中4个酚-OH,若R含-CO-、3个酚-OH,R′含-OH时,消耗NaOH最多;
C.儿茶素可溶于有机溶剂;
D.R含-CO-分子中含-COOC-.
解答 解:A.儿茶素含酚-OH,则能与FeCl3溶液发生显色反应,故A正确;
B.儿茶素中4个酚-OH,若R含-CO-、3个酚-OH,R′含-OH时,消耗NaOH最多,则1mol儿茶素最多可与9mol NaOH反应,故B错误;
C.常温下,儿茶素不溶于水,可溶于有机溶剂,故C错误;
D.R含-CO-分子中含-COOC-,可发生水解反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意酚、酯的性质,题目难度不大.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸表现出了氧化性和酸性 | B. | 还原剂与氧化剂之比为1:4 | ||
| C. | 每个硝酸分子得到2个电子 | D. | 硝酸铜是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Na+2H2O=2NaOH+H2↑是酸碱反应 | |
| B. | ClO-+H2O?HClO+OH-是酸碱反应 | |
| C. | 碱性强弱顺序:OH->ClO->CH3COO- | |
| D. | HCO3-既是酸又是碱,NH3既不是酸又不是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素在自然界中都有游离态 | |
| B. | X分别与W、Y、Z都可组成具有漂白性的物质,且它们的漂白原理相同 | |
| C. | 元素W、Y的氯化物中,各原子(或离子)均满足8电子的稳定结构 | |
| D. | 元素W可与元素X形成一种既含极性键又含非极性键的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| B. | 用催化剂能提高反应物的平衡转化率 | |
| C. | 平衡时其他条件不变,升高温度能提高COCl2的转化率 | |
| D. | 当反应达平衡时,恒温恒压条件下通入Ar能提高COCl2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 蒸发结晶时应将溶液完全蒸干 | |
| D. | 洗涤沉淀的方法是向漏斗中加水,使水没过沉淀,等水流完后再重复操作几次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y |
| A. | 元素的第一电离能X<Y | |
| B. | X位于第三周期 IIA,其单质可采用电解熔融其氯代物制备 | |
| C. | 元素最高价氧化物的水化物中,酸性最强的是HNO3 | |
| D. | 气体分子(MN)2的电子式为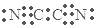 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com