
 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为| 4mol×2mol |
| 4mol |
| 87g×2mol |
| 2mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温下,pH=2的HCl与pH=12的NH3?H2O 等体积混合后溶液呈酸性 |
| B、常温下,用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗醋酸溶液体积分别为Va,Vb,则Vb<10Va |
| C、常温下,向体积为V1L的浓度均为0.1mol/L HCl、CH3COOH混合溶液中加入 V2L 0.2mol/L的NaOH溶液后,溶液呈中性,则V1>V2 |
| D、常温下,pH为2的硫酸与0.01mol/L的NaOH溶液等体积混合后,混合溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 | ||||
| S | 112.8 | 444.6 | 略 | ||||
| S2Cl2 | -77 | 137 | 遇水生成HCl、SO2、S;300℃以上完全分解; S2Cl2+Cl2
|
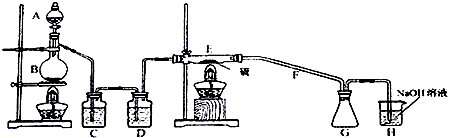
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.04 | 0.25 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
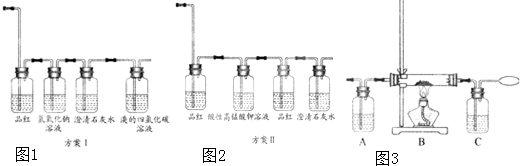
查看答案和解析>>
科目:高中化学 来源: 题型:


| H2O |
| LiAlH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com