
分析 (1)氢氧化钠为强电解质,完全电离出钠离子和氢氧根离子;
(2)HCl为强电解质,在溶液中完全电离出氢离子和氯离子;
(3)碳酸钠为强电解质,在溶液中完全电离;
(4)氢氧化钠足量,二者反应生成硫酸钠和水;
(5)氢氧化铝与盐酸反应生成氯化铝和水.
解答 解:(1)氢氧化钠为强电解质,完全电离,电离方程式为:NaOH=Na++OH-,
故答案为:NaOH=Na++OH-;
(2)HCl为强电解质,完全电离,电离方程式为:HCl=H++Cl-,
故答案为:HCl=H++Cl-;
(3)Na2CO3为强电解质,在溶液中完全电离出钠离子和碳酸根离子,其电离方程式为:Na2CO3=2Na++CO32-,
故答案为:Na2CO3=2Na++CO32-;
(4)三氧化硫(SO3)与足量NaOH的反应生成硫酸钠和水,反应的化学方程式为:2NaOH+SO3=Na2SO4+H2O,
故答案为:2NaOH+SO3=Na2SO4+H2O;
(5)氢氧化铝中[Al(OH)3]和胃酸(HCl)反应的原理为:Al(OH)3+3HCl=AlCl3+3H2O,
故答案为:Al(OH)3+3HCl=AlCl3+3H2O.
点评 本题考查了化学方程式、电离方程式的书写,题目难度中等,明确发生反应原理为解答关键,注意掌握电离方程式的书写原则,试题培养了学生的灵活应用能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:推断题
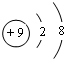 ,C的原子结构示意图为
,C的原子结构示意图为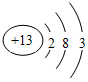 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
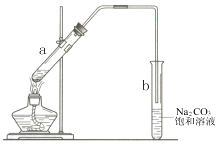
| A. | 向试管a中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠盐 | B. | 碳酸盐 | C. | 碱性氧化物 | D. | 电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 | |
| B. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol•L-1)通常需要用容量瓶等仪器 | |
| C. | 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解 | |
| D. | 用pH=1的盐酸配制100 mL pH=2的盐酸所需全部玻璃仪器有100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的电负性大小顺序是Z<Y<X | |
| B. | WY2分子中σ键与π键的数目之比是2:1 | |
| C. | W、X、Y、Z的原子半径大小顺序是X>Y>Z>W | |
| D. | W、Z形成的分子的空间构型是三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | NaCl+AgNO3=AgCl↓+NaNO3 | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | CaO+H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 除去KNO3中混杂的NaCl,可用重结晶的方法,是因为氯化钠在水中溶解度大 | |
| C. | 用量筒量取20mL 0.5 mol•L-1H2SO4于烧杯中,加水80mL,配制成0.1 mol•L-1H2SO4溶液 | |
| D. | 将足量的Na2O、Na2O2分别加入到酚酞溶液中,最终溶液均为红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com