
【题目】某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程如下图,已知沉淀2为蓝色。
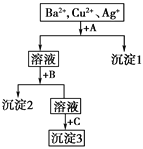
(1)写出沉淀的化学式:沉淀1______;沉淀3________。
(2)写出混合液+A的离子方程式_________________,溶液+B的离子方程式________________。
【答案】AgCl BaSO4Ag++Cl=== AgCl↓H++OH=== H2O,Cu2++2OH=== Cu(OH)2↓
【解析】
(1)根据沉淀2为蓝色可推断沉淀2为氢氧化铜,溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后再加入NaOH得到Cu(OH)2沉淀,最后加入Na2SO4,可得到BaSO4沉淀,所以沉淀1是氯化银,沉淀2是氢氧化铜,沉淀3是硫酸钡;
(2)混合液+A反应的离子方程式为Ag++Cl=== AgCl↓,沉淀2为Cu(OH)2,溶液中含有过量的氢离子,溶液+B反应的离子方程式为:H++OHH2O,Cu2++2OH=== Cu(OH)2↓。


科目:高中化学 来源: 题型:
【题目】根据下图所示A、B、C、D、E的变化关系,回答下列问题:
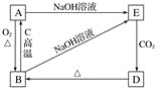
(1)写出A、D的名称:A__________,D__________。
(2)写出B→A的化学方程式:______________。
(3)写出下列反应的离子方程式:
A→E:__________________________________;B→E:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. NO2通入水中:3NO2+H2O=2H++2NO2-+NO
B. Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3↓+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:
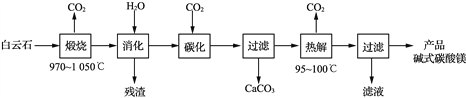
(1) “煅烧”时发生主要反应的化学方程式为____________________________。
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
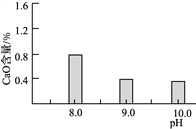
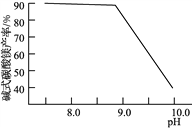
图1 CaO含量与碳化终点pH的关系 图2 碱式碳酸镁产率与碳化终点pH的关系
①应控制“碳化”终点pH约为________,发生的主要反应的化学方程式为______________________和____________________。
②图2中,当pH=10.0时,镁元素的主要存在形式是____________(写化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为________________________________。
(4)该工艺为达到清洁生产,可以循环利用的物质是____________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同种类型的物质往往具有某些相同的性质.下列性质中不属于酸的通性的是( )
A.与碱反应生成盐和水
B.使紫色石蕊试液变蓝色
C.与活泼金属反应生成盐和氢气
D.与氧化钠反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过反应 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。
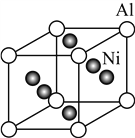
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
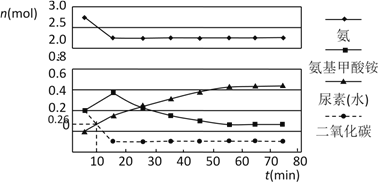
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
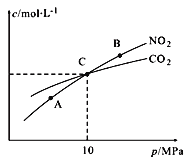
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是( )
A.K+、H+、SO42-、MnO4-B.Na+、Ca2+、Cl-、NO3-
C.Ag+、H+、Cl-、CH3COO-D.Ba2+、K+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入苯、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色D.Ⅳ中溶液分层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com