
【题目】1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.lmol1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g)![]() CH2=CHCH=CH2(g)+H2(g)△H。
CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)已知化学键键能数据如下,由此计算△H=____________kJmo1-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJmol-1 | 348 | 612 | 412 | 436 |
(2)如图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度600℃。
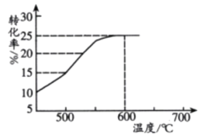
①请解释工业生产控制温度在600℃的原因___________。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=_________kPah-1;脱氢反应的平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,p分=p总×物质的量分数)。
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,化学反应向_________(填“正反应”、“逆反应或“不移动”)方向进行 。
【答案】124 600℃时1-丁烯的平衡转化率高,催化剂活性强 1 ![]() 正反应
正反应
【解析】
(1)根据表格键能数据,△H=反应物总键能-生成物总键能;
(2)①催化剂的活性与温度有关;
②根据图中数据,列“三段式”计算解答;
(3)根据Qc与平衡常数K的关系分析判断反应进行的方向。
(1)根据表格键能数据,△H=反应物总键能-生成物总键能=8EC-H+2EC-C+ EC=C-6EC-H- EC-C- 2EC=C-EH-H=2EC-H+EC-C-EC=C-EH-H=2×412kJmol-1+348kJmol-1-612kJmol-1-436kJmol-1=+124kJmol-1;
(2)①催化剂的活性与温度有关,600℃时催化剂的活性最大,1-丁烯的平衡转化率高;
②根据图表数据,600℃达到平衡时,1-丁烯的转化率为25%,列“三段式”:
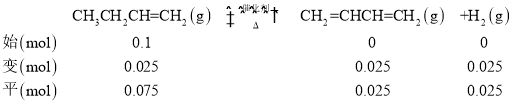
p(H2)= 80kPa×![]() =2.5kPa,p(CH2=CHCH=CH2)=80kPa×
=2.5kPa,p(CH2=CHCH=CH2)=80kPa×![]() =2.5kPa,p(CH3CH2CH=CH2)= 80kPa×
=2.5kPa,p(CH3CH2CH=CH2)= 80kPa×![]() =7.5kPa,则以H2表示的反应速率为v(H2)=
=7.5kPa,则以H2表示的反应速率为v(H2)=![]() = 1kPah-1,平衡常数Kp=
= 1kPah-1,平衡常数Kp=![]()
![]() ;
;
(3)在密闭容器中反应达到平衡后,再充入1.575mol1-丁烯和1.625mol1,3-丁二烯,n(CH3CH2CH=CH2)= 1.575mol+0.075mol=1.65mol,n(CH3CH2CH=CH2)= 1.625mol+0.025mol=1.65mol,则此时p(H2)= 80kPa×![]() =0.5kPa,p(CH2=CHCH=CH2)=80kPa×
=0.5kPa,p(CH2=CHCH=CH2)=80kPa×![]() =16.5kPa,p(CH3CH2CH=CH2)= 80kPa×
=16.5kPa,p(CH3CH2CH=CH2)= 80kPa×![]() =16.5kPa,Qc=
=16.5kPa,Qc=![]() =0.5 kPa<K=
=0.5 kPa<K=![]() ,反应未达到平衡,向正反应方向移动。
,反应未达到平衡,向正反应方向移动。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有0.5molL-1盐酸、0.55molL-1NaOH溶液及如图的仪器,尚缺少的实验玻璃用品是____。

(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?____(填“能”或“否”),其原因是 ____。
(3)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热△H(平均值) | ||
t1 | t2 | |||
① | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.3℃ | ____ |
② | 50mL0.55molL-1NaOH 50mL.0.5molL-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ℃-1Kg-1,各物质的密度均为1gcm-3。完成表格。
(4)若用KOH代替NaOH,对测定结果____(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是
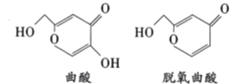
A.两物质都能使溴的四氯化碳溶液褪色
B.曲酸经消去反应可得脱氧曲酸
C.1mol脱氧曲酸最多能与3molH2发生加成反应
D.曲酸与脱氧曲酸中含有相同种类的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01molL-1的KSCN、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示。下列叙述错误的是

A.Ksp(Ag2CrO4)的数值为10-9.92
B.a点表示的是Ag2CrO4的不饱和溶液
C.沉淀废液中的Ag+用K2CrO4溶液比等浓度的KSCN溶液效果好
D.Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO42-(aq)的平衡常数为1012.08
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国采用的Cu2O/TiO2–NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:
(1)钛(Ti)的基态原子M能层中能量不同的电子有_____________种。
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、![]() 分子中O-H键的极性最强的是_____________。
分子中O-H键的极性最强的是_____________。
②C、N、O三种元素的电负性由大到小的顺序是_____________。
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为_____________mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是_____________。
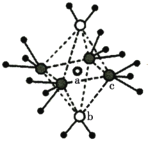
(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为_____________gcm-3 (用含r和NA数学表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一未知浓度的盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
配制100mL0.10molL-1NaOH标准溶液。取20.00mL待测盐酸放入锥形瓶中,滴加 2~3滴酚酞作指示剂,用配制的标准 NaOH溶液进行滴定。重复上述滴定操作 2~3次,记录数据如下:
滴定次数 | 待测盐酸的体积/mL | 0.10 mol/L NaOH 溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 20.00 | 2.00 | 28.15 |
第二次 | 20.00 | 1.50 | 29.50 |
第三次 | 20.00 | 0.20 | 26.55 |
①该实验滴定达到终点的标志是____
②根据上述数据,可计算出该盐酸的浓度约为___。(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有____。(双选)
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH 固体时,混入少量KOH杂质
④现用以上实验配制的0.10molL-1NaOH溶液滴定未知浓度的CHCOOH溶液,反应恰好完全时,下列叙述中正确的是___
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从接触法制硫酸的废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | VOSO4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
一种废钒催化剂回收工艺路线流程如下:
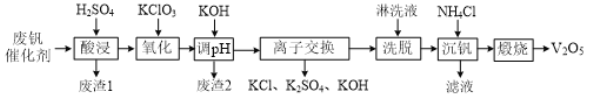
回答下列问题:
(1)“酸浸”时为了提高钒元素的浸出率,可以采取的措施是______。
(2)“酸浸”时可以得到![]() 和VO2+,“氧化”时VO2+转化为
和VO2+,“氧化”时VO2+转化为![]() 的离子方程式为______。
的离子方程式为______。
(3)“调pH”后钒以![]() 形式存在于溶液中。“废渣2”所含成分的化学式为____。
形式存在于溶液中。“废渣2”所含成分的化学式为____。
(4)“离子交换”和“洗脱”的过程可表示为:4ROH+![]()
![]() R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
R4V4O12+4OH (ROH为某种碱性阴离子交换树脂)。流程中进行“离子交换”和“洗脱”的目的是______。
(5)“沉钒”时得到偏钒酸铵(NH4VO3)沉淀。
①检验偏钒酸铵沉淀是否洗涤干净的方法是______。
②“煅烧”中发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质子膜N2H4燃料电池是一种高效无污染的新型电池(原理示意如图),其反应原理:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-544kJmol-1。下列说法正确的是

A.电极b上发生氧化反应
B.电极a为原电池正极
C.每32gO2参与反应,电池内部释放544kJ热能
D.电路中每通过1mol电子,有1molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A. H2S+2HNO3===S↓+2NO2↑+2H2O
B. CuO+2HNO3===Cu(NO3)2+H2O
C. 4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
D. 3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com