
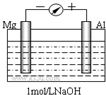
 实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以稀NaOH溶液为电解质溶液构成的原电池,人们普遍认为铝是负极.某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:分析 (1)开始阶段,铝片表面有许多气泡,则原电池的正极是Al片;铝片表面产生的气泡是H2,负极是镁;
(2)随后阶段,负极是铝,正极是镁,电极反应式:O2+2H2O+4e-=4OH-.
解答 解:(1)开始阶段,原电池的正极是Al片;铝片表面产生的气泡是H2,负极是镁,电极反应式:Mg+2OH--2e-=Mg(OH)2,
故答案为:Al;H2;Mg+2OH--2e-=Mg(OH)2 ;
(2)随后阶段,负极是铝,电极反应式:Al+4OH--3e-=AlO2-+2H2O,正极是镁,电极反应式:O2+2H2O+4e-=4OH-;铝片中含有杂质构成原电池,放出气体,
故答案为:Al+4OH--3e-=AlO2-+2H2O;O2+2H2O+4e-=4OH-; 铝片中含有杂质构成原电池.
点评 本题考查了原电池原理,难度不大,正确判断原电池正负极是解本题关键,注意:不能根据金属的活泼性强弱判断正负极,要根据具体的反应来判断,为易错点.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mol•L-1CH3COOH溶液中,CH3COOH分子数为NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| C. | 标准状况下,22.4L甲醇完全燃烧后生成的CO2分子数目约为NA | |
| D. | 2.8 g乙烯和丁烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变为原来的10-3倍 | B. | 变为原来的10-2倍 | ||
| C. | 变为原来的10倍 | D. | 不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H 2CO 3<C 6H 5OH<H 3COOH | B. | 碱性:Ba(OH) 2<Ca(OH) 2<KOH | ||
| C. | 熔点:MgBr 2<SiCl 4<BN | D. | 沸点:PH 3<NH 3<H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使红色石蕊试纸变蓝,也能使淀粉碘化钾试纸变蓝 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与过量锌粉反应的离子方程式为:Zn+2Fe3+═2Fe2++Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com