
分析 Na通入硫酸铜溶液中时,先和水反应生成NaOH和氢气,然后NaOH再和硫酸铜发生复分解反应生成氢氧化铜蓝色沉淀,据此分析解答.
解答 解:Na通入硫酸铜溶液中时,先和水反应生成NaOH和氢气,然后NaOH再和硫酸铜发生复分解反应生成氢氧化铜蓝色沉淀,所以看到的现象是有无色气体生成且生成蓝色沉淀,离子方程式为2Na+Cu2++2H2O=H2↑+Cu(OH)2↓+2Na+,
故答案为:产生无色气体和蓝色沉淀;2Na+Cu2++2H2O=H2↑+Cu(OH)2↓+2Na+.
点评 本题考查元素化合物的性质,为高频考点,明确钠性质的活泼性是解本题关键,注意反应先后顺序及产生的现象,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.35mol/L | B. | 0.45mol/L | C. | 0.5mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘高 | B. | 右盘高 | C. | 仍保持平衡 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.查看答案和解析>>
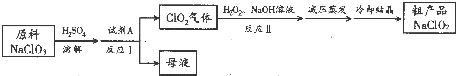
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
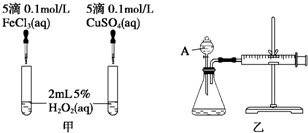
科目:高中化学 来源: 题型:实验题
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com