
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成3种不同的一氯取代物。该烃的结构简式是( )

 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
⑴ 已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和
-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的
甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
⑵ 在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得
CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
|

 | 0 | 1 | 2 | 3 | 4 | ||||||
| CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 | ||||||
| H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
⑶ 已知温度、压强、投料比X对该反应的影响如图所示。
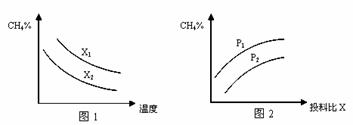
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
⑷ 以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下
的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.分子组成相差1个或若干个CH2原子团的物质互称为同系物
B.相对分子质量相同的有机物是同分异构体
C.碳原子之间只以单键相结合的链烃为烷烃
D.分子式相同的有机物一定是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenynol)。下列有关说法不正确的是( )

A.牛式二烯炔醇分子内含有两种官能团
B.牛式二烯炔醇能够发生加聚反应得到高分子化合物
C.牛式二烯炔醇在一定条件下能与乙酸发生酯化反应
D.牛式二烯炔醇可使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B两种有机物的有关信息:
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为 ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为: |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做
________________________________________________________________________;
写出在一定条件下,A生成高分子化合物的化学反应方程式:
________________________________________________________________________。
(2)A与氢气发生加成反应后生成C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=________时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤能使酸性KMnO4溶液和溴水褪色、⑥任何条件下不与氢气反应。
写出在浓硫酸作用下,B与浓硝酸在60℃反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·L-1的氨水b L,②c(OH-)=10-3 mol·L-1的氨水c L,③c(OH-)=10-3 mol·L-1的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液中相比较______(填溶质的化学式)溶液中NH 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25 ℃时,AgCl的Ksp=1.8×10-10mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水 ②100 mL 0.3 mol·L-1 AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号),此时溶液②中Cl-物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
水是最宝贵的资源之一。下列表述正确的是( )
A.H2O的电子式为H+[
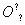
 H]-
H]-
B.4℃时,纯水的pH=7
C.D O中,质量数之和是质子数之和的两倍
O中,质量数之和是质子数之和的两倍
D.273 K、101 kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com