
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ①④ |
科目:高中化学 来源: 题型:选择题
| A. | 向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 | |
| B. | 将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 | |
| C. | 在0.01mol/L NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 | |
| D. | CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3?Ca2++CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mo/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ②④ | C. | ①②⑤ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
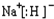 ;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;CA与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com