
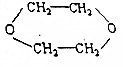 ,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2)
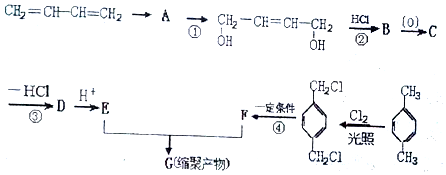
,写出各步反应的化学方程式(一定要注明反应条件,有机物一定要写结构简式)(提示:电解食盐水可得NaOH,Cl2和H2) 分析 由信息可知卤代烃在碱性水溶液中水解生成醇,则以CH3CH2OH为原料合成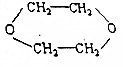 ,应先发生消去反应生成乙烯,再与氯气发生加成反应,最后再碱性溶液中水解可得到乙二醇,2分子乙二醇分子间脱水可生成
,应先发生消去反应生成乙烯,再与氯气发生加成反应,最后再碱性溶液中水解可得到乙二醇,2分子乙二醇分子间脱水可生成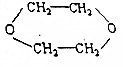 ,以此解答该题.
,以此解答该题.
解答 解:以CH3CH2OH为原料合成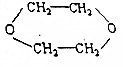 步骤为:
步骤为:
①CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O;
②CH2=CH2+Cl2→CH2ClCH2Cl,
③CH2ClCH2Cl+2H2O$→_{△}^{NaOH/水}$HOCH2CH2OH+2HCl,
④2HOCH2CH2OH$→_{△}^{浓硫酸}$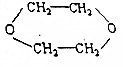 +2H2O,
+2H2O,
答:各步的方程式为①CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O;
②CH2=CH2+Cl2→CH2ClCH2Cl,
③CH2ClCH2Cl+2H2O$→_{△}^{NaOH/水}$HOCH2CH2OH+2HCl,
④2HOCH2CH2OH$→_{△}^{浓硫酸}$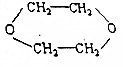 +2H2O.
+2H2O.
点评 本题考查有机物的合成,为高频考点,侧重考查学生的分析能力,明确常见的反应类型、物质结构与性质的关系,结合信息来分析合成步骤是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②⑥⑧ | C. | ②③⑤⑦⑧ | D. | ①②④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
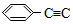 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 侧链所有碳原子可能共直线 | ||
| C. | 所有碳原子可能共面 | D. | 最多有18原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO、CO、烟尘 | B. | CO2、Cl2、N2、雾 | C. | HCl、NO2、N2、粉尘 | D. | CO2、NO、NH3、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、-COOH.
、-COOH. .
. 的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.
的同分异构体中含有苯环,且苯环上有三个取代基的同分异构体有16种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2 和 1molO2 混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256g S8 分子中含 S-S 键为 7NA 个 | |
| C. | 由 1molCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为 NA 个 | |
| D. | 1 mol Na 与 O2 完全反应,生成 NaO2 和 Na2O2的混合物,转移电子总数为 NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
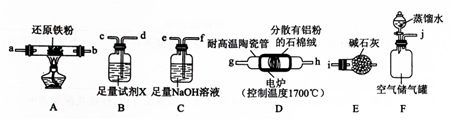
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com